
Home
Giáo dục đào tạo
Tài liệu, đề thi Hóa Học
Đề thi giữa học kì 1 môn Hóa học lớp 11 trường THPT Nguyễn Văn Cừ, Bắc Ninh năm học 2015 - 2016
Đề thi giữa học kì 1 môn Hóa học lớp 11 trường THPT Nguyễn Văn Cừ, Bắc Ninh năm học 2015 - 2016
SỞ GD&ĐT BẮC NINH
TRƯỜNG THPT NGUYỄN VĂN CỪ
ĐỀ THI GIỮA HỌC KÌ 1 NĂM HỌC 2015 - 2016
MÔN: HÓA HỌC - LỚP 11
Thời gian làm bài: 60 phút
Cho biết nguyên tử khối của các nguyên tố là: H = 1; C = 12; N = 14; O = 16; Na = 23; S
= 32; K = 39; Fe = 56, Cu = 64; Zn = 65.
Phần I: Trắc nghiệm: 2,5 điểm
Câu 1: Cho dãy các chất sau: HCl, H2SO4, H3PO4, NaOH, C2H5OH, Ba(OH)2, Fe(NO3)3,
NH4Cl, KAlO2. Số chất điện li mạnh là:
A. 6 B. 7 C. 8 D. 9
Câu 2: Cho các chất sau: KOH, Ca(OH)2, Al(OH)3, Zn(OH)2, Sn(OH)2 và Pb(OH)2. Số
chất có tính chất lưỡng tính là:
A. 2. B. 3 C. 4 D. 5
Câu 3: Khi trộn 100 ml dung dịch Ba(OH)2 0,125M với 400 ml dung dịch HCl 0,05M thu
được dung dịch có pH là:
A. 2 B. 6 C. 10 D. 12
Câu 4: Dãy gồm các ion có thể cùng tồn tại trong một dung dịch là:
A. NH4+, NO3-, HCO3-, OH- B. K+, H+, SO42-, OH-
C. Na+, NH4+, H+,CO3 2- D. Ca2+, Fe2+, NO3-, Cl-
Câu 5: Thể tích dung dịch HNO3 0,3M vừa đủ để trung hòa 100 ml dung dịch chứa hỗn
hp NaOH 0,1M và Ba(OH)2 0,1M là
A. 100 ml B. 150ml C. 200 ml D. 250 ml
Câu 6: Cho phản ứng hóa học NaOH + HCl → NaCl + H2O. Phản ứng hóa học nào sau
đây có cùng phương trình ion rút gọn với phản ứng trên?
A. 2KOH + FeCl2 → Fe(OH)2 + 2KCl
B. NaOH + NaHCO3 → Na2CO3 + H2O
C. NaOH + NH4Cl → NaCl + NH3 + H2O
D. KOH + HNO3 → KNO3 + H2O
Câu 7: Cho thí nghiệm như hình vẽ, bên trong bình có chứa khí NH3, trong chậu thủy tinh
chứa nước có nhỏ vài giọt phenolphthalein. Hiện tượng xảy ra trong thí nghiệm là:
A. Nước phun vào bình và chuyển thành màu xanh.
B. Nước phun vào bình và chuyển thành màu hồng.
C. Nước phun vào bình và không có màu.
D. Nước phun vào bình và chuyển thành màu tím.
Câu 8: Hòa tan hoàn toàn 13 gam Zn trong dung dịch HNO3 loãng, dư thu được dung
dịch X và 0,448 lít khí N2 (đktc). Khối lượng muối trong dung dịch X là:
A. 37,8 gam B. 18,9 gam C. 28,35 gam D. 39,8 gam
Câu 9: Dung dịch X gồm a mol Na+; 0,15 mol K+; 0,1 mol HCO3-; 0,15 mol CO32- và 0,05
mol SO42-. Tổng khối lượng muối trong dung dịch X là:
A. 33,8 gam B. 28,5 gam C. 29,5 gam D. 31,3 gam
Câu 10: Cho 3,2 gam Cu tác dụng với 100 ml dung dịch gồm HNO3 0,8M và
H2SO4 0,2M. Sau khi các phản ứng xảy ra hoàn toàn, sinh ra V lít khí NO (sản phẩm khử
duy nhất, ở đktc). Giá trị của V là:
A. 0,448 B. 0,792 C. 0,672 D. 0,746
Phần II: Tự luận. 7,5 điểm
Câu 1: (2,0 điểm)
Chỉ dùng một hóa chất, hãy trình bày phương pháp hóa học phân biệt ba dung dịch sau
đụng trong các lọ mất nhãn sau: NH4Cl, (NH4)2SO4 và KNO3. Viết các phương trình hóa
học xảy ra.
Câu 2: (2,0 điểm)
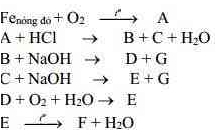
Viết phương trình phản ứng thực hiện dãy biến hóa sau (ghi rõ điều kiện nếu có)
NH4NO2 → N2 → NH3 → NO → NO2 → HNO3 → Cu(NO3)2 → O2
↓
Al(OH)3
Câu 3: (3,5 điểm)
Hòa tan hoàn toàn 23,6 gam hỗn hợp gồm Cu và Fe vào dung dịch HNO3 2M (dư), thu
được dung dịch A và 7,84 lít khí NO (sản phẩm khử duy nhất ở đktc)
1. Tính thành phần % khối lượng mỗi kim loại trong hỗn hợp đầu.
2. Tính khối lượng muối khan thu được khi cô cạn dung dịch A.
3. Tính thể tích của dung dịch HNO3 ban đầu (biết rằng dùng dư 10% so với lượng cần
phản ứng)
---------- Hết ----------
SỞ GD&ĐT BẮC NINH
TRƯỜNG THPT NGUYỄN VĂN CỪ
ĐÁP ÁN ĐỀ THI GIỮA HỌC KÌ 1
NĂM HỌC 2015 - 2016
MÔN: HÓA HỌC - LỚP 11
Phần I. Trắc nghiệm. Mỗi câu đúng 0,25 điểm
1. B
2. C
3. D
4. D
5. A
6. D
7. B
8. D
9. A
10. C
Phần 2: Tự luận.
Câu 1
- Dùng dung dịch Ba(OH)2
- Trình bày lời đúng cho 1,0 điểm.
- Viết phương trình phản ứng đúng cho 1,0 điểm
Câu 2: Mỗi phương trình đúng cho 0,25 điểm
Câu 3
1. 2,0 điểm.
- Viết phương trình phản ứng đúng cho 0,5 điểm
- Lập hệ phương trình đúng cho 0,5 điểm
- Giải hệ phương trình ra số mol Fe = 0,25 mol. Số mol Cu = 0,15 cho 0,5 điểm
- Tính ra % Fe = 59,32%, % Cu = 40,68% cho 0,5 điểm
2, Tìm ra khối lượng 2 muối = 88,7 gam. Cho 0,75 điểm
3, Số mol HNO3 = 1,4 mol, thể tích HNO3 đủ = 0,7 lít, thể tích HNO3 dư 10% = 0,77 lít.
Cho 0,75 điểm
có thể bạn quan tâm

Tiếng Anh lớp 3 - Đề thi học kỳ 2 trường Tiểu học Nguyễn Văn Hài, Cà M...
8
2.235
339
Tiếng Anh trẻ em
8
(New)

CD Tiếng Anh lớp 3 - Đề thi học kỳ 2 trường Tiểu học Phúc Thuận 2, Thá...
0
772
376
Tiếng Anh trẻ em
(New)

Tiếng Anh lớp 3 - Đề thi học kỳ 2 trường Tiểu học Phúc Thuận 2, Thái N...
6
1.232
336
Tiếng Anh trẻ em
6
(New)

Đề thi học sinh giỏi Toán lớp 9 tỉnh Bắc Ninh năm 2015-2016
1
1.248
326
Tài liệu, đề thi môn Toán
1
(New)

Đáp án đề thi học sinh giỏi Toán lớp 9 cấp tỉnh Bắc Ninh năm học 2015...
4
4.060
377
Tài liệu, đề thi môn Toán
4
(New)
Đề thi học sinh giỏi môn Lịch sử lớp 12 tỉnh Bắc Ninh năm học 2015 - 2...
7
1.777
473
Tài liệu, đề thi học sinh giỏi
7
(New)

Đề thi thử tốt nghiệp THPT lần 2 môn toán lớp 12 năm học 2016-2017 trư...
8
1.051
332
Tài liệu, đề thi môn Toán
8
(New)

Đề thi kiểm tra Địa lý 11 trường THPT Lý Thái Tổ Bắc Ninh
5
869
403
Tài liệu, đề thi khác
5
(New)
thông tin tài liệu
Đề thi giữa học kì 1 môn Hóa học lớp 11 trường THPT Nguyễn Văn Cừ, Bắc Ninh năm học 2015 - 2016. Đề gồm 2 phần trắc nghiệm và tự luận với thời gian làm bài là 60 phút, chúng tôi đã cập nhật đầy đủ và chính xác đáp án để các bạn có thể đố chiếu kết quả trong quá trình làm bài. Mời các bạn tham khảo.
Mở rộng để xem thêm
tài liệu mới trong mục này
tài liệu hot trong mục này
Bài tập trắc nghiệm Hóa học lớp 11 chương 1: Sự điện li
Trắc nghiệm Hóa học 10 bài 2: Hạt nhân nguyên tử. Nguyên tố hóa học. Đồng vị
Phương pháp giải các dạng bài tập về tính lưỡng tính của Al(OH)3
Tổng hợp các dạng bài tập Hóa học Phân loại bài tập hóa học theo từng dạng
Lý thuyết tổng quan, câu hỏi trắc nghiệm và các bài tập vận dụng chuyên đề Este
tài liệu giúp tôi
Nếu bạn không tìm thấy tài liệu mình cần có thể gửi yêu cầu ở đây để chúng tôi tìm giúp bạn!
xem nhiều trong tuần
Địa lý 12 Phát triển cây công nghiệp lâu năm Tây Nguyên
Đề thi và lời giải môn xác suất thống kê của trường Học viện ngân hàng
Giáo trình Quản trị học của Đại học kinh tế quốc dân
MẪU GIẤY THI A4
Bài tập ôn tập cuối tuần lớp 2: Tuần 31
MẪU GIỚI THIỆU CHUYỂN SINH HOẠT HỘI
yêu cầu tài liệu
Giúp bạn tìm tài liệu chưa có
×



