
Home
Giáo dục đào tạo
Giải bài tập các môn
Giải bài tập Hóa lớp 9: Sơ lược về bảng tuần hoàn các nguyên tố hoá học
Giải bài tập Hóa lớp 9: Sơ lược về bảng tuần hoàn các nguyên tố hoá học
Gi i bài t p Hóa l p 9: ả ậ ớ S l c v b ng tu n hoàn các nguyên t hoá h cơ ượ ề ả ầ ố ọ
I. Tóm t t ki n th c c b n: ắ ế ứ ơ ả S l c v b ng tu n hoàn các nguyên t hoá h cơ ượ ề ả ầ ố ọ
1. Nguyên t c s p x p các nguyên t trong b ng tu n hoànắ ắ ế ố ả ầ
Trong b ng tu n hoàn, các nguyên t đ c s p x p theo chi u tăng d n c a đi n tíchả ầ ố ượ ắ ế ề ầ ủ ệ
h t nhân nguyên t .ạ ử
2. C u t o b ng tu n hoànấ ạ ả ầ
a. Ô nguyên tố
Ô nguyên t cho bi t: S hi u nguyên t , kí hi u hóa h c, tên nguyên t , nguyên tố ế ố ệ ử ệ ọ ố ử
kh i c a nguyên t ố ủ ố đó'
b. Chu kì
- Chu kì là dãy các nguyên t mà nguyên t c a chúng có cùng s l p electron và đ cố ử ủ ố ớ ượ
x p theo chi u đi n tích h t nhân tăng d n.ế ề ệ ạ ầ
- S th t chu kố ứ ự ì b ng s l p electron.ằ ố ớ
- B ng tu n hoàn hi n có 7 chu kì, các chu kì 1, 2, 3 là chu kì nh ; các chu kì 4, 5, 6, 7 làả ầ ệ ỏ
chu kì l n.ớ
c. Nhóm
- Nhóm g m các nguyên t mà nguyên t c a chúng có sồ ố ử ủ ố electron l p ngoài cùng b ngớ ằ
nhau, do đó có tính chât t ng t nhau.ươ ự
- M i nhóm đ c x p thành m t c t theo chi u tăng c a đi n tích h t nhân. B ng tu nỗ ượ ế ộ ộ ề ủ ệ ạ ả ầ
hoàn có 8 nhóm A và 8 nhóm B. Nhóm IA (tr H) là các kim lo i m nh, g i là các kimừ ạ ạ ọ
lo i ki m; Nhóm VIIA là các phi kim m nh, g i là nhóm halogen; Nhóm VIIIA là cácạ ề ạ ọ
khí hi m (hay khí tr ).ế ơ
- S th t c a các nhóm A b ng s electrdn l p ngoài cùng c a nguyên t trongố ứ ự ủ ằ ố ở ớ ủ ử
nhóm đó.
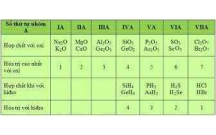
3. S bi n đ i tính ch t c a các nguyên t trong b ng tu n hoànự ế ổ ấ ủ ố ả ầ
3. Ý nghĩa c a b ng tu n hoànủ ả ầ
a. Bi t v trí c a nguyên tế ị ủ ố ta có th suy đoán c u t o nguyên t và tính ch t c aể ấ ạ ử ấ ủ
nguyên t .ố
Thí d :ụ Nguyên tố A có s hi u nguyên t là 17, chu kì 3, nhóm VIIA. Hãy cho bi t c uố ệ ử ế ấ
t o nguyên t , tính ch t nguyên tạ ử ấ ử A và so sánh v i các nguyên t bên c nh.ớ ố ạ
Gi i: S hi u nguyên t là 17, suy ra ả ố ệ ử đi n tích h t nhân c a nguyên t A là 17+, nguyênệ ạ ủ ử
t A có 17 electron.ử
- chu kì 3, suy ra nguyên t A có 3 l p electron; nhóm VIIA suy ra l p ngoài cùng cóỞ ử ớ ớ
7e.
- Nguyên t A (Cl) cu i chu kì 3 nên là m t phi kim m nh, tính phi kim c a A m nhố ở ố ộ ạ ủ ạ
h n c a nguyên t tr c nó trong cùng chu kì (là s có s hi u là 16) và nguyên t đ ngơ ủ ố ướ ố ệ ố ứ
d i nó trong cùng nhóm (là Br có s hi u nguyên t là 35) nh ng kém nguyên t phíaướ ố ệ ử ư ố
trên nó trong cùng nhóm (là F có s hi u nguyên t là 9).ố ệ ử
b. Bi t c u t o nguyên t c a nguyên t có th suy đoán v trí và tính ch t nguyên tế ấ ạ ử ủ ố ể ị ấ ố
đó.
Thí d :ụ Nguyên t X có đi n tích h t nhân là 11+, 3 l p electron, l p ngoài cùng có 1ố ệ ạ ớ ớ
electron.
Hãy cho bi t v trí c a X trong b ng tu n hoàn và tính ch t c b n c a nó.ế ị ủ ả ầ ấ ơ ả ủ
Gi i:ả
- Vì nguyên t X có đi n tích h t nhân là 11+, 3 l p electron và có le l p ngoài cùng,ử ệ ạ ớ ở ớ
suy ra nguyên t X ô 11, chu kì 3, nhóm IA.ố ở
- Nguyên t A đ u chu kì nên tính ch t hóa h c c b n là tính kim lo i.ố ở ầ ấ ọ ơ ả ạ
Ngoài ra, b ng tu n hoàn các nguyên t hóa h c là c s khoa h c quan tr ng giúp ta cóả ầ ố ọ ơ ở ọ ọ
ph ng pháp h c t p, nghiên c u hóa h c m t cách có h th ng.ươ ọ ậ ứ ọ ộ ệ ố
II. Gi i bài t p trang 101 SGK Hóa l p 9ả ậ ớ
Bài 1. D a vào b ng tu n hoàn, hãy cho bi t c u t o nguyên t , tính ch t kim lo i, phiự ả ầ ế ấ ạ ử ấ ạ
kim c a các nguyên t có s hi u nguyên t 7, 12, 16.ủ ố ố ệ ử
H ng d nướ ẫ gi i:ả
Bài 2. Bi t X có c u t o nguyên t nh sau: đi n tích h t nhân là 11+, 3 l p electron,ế ấ ạ ử ư ệ ạ ớ
l p ngoài cùng có 1 electron. Hãy suy ra v trí c a X trong b ng tu n hoàn và tính ch tớ ị ủ ả ầ ấ
hoá h c c b n c a nóọ ơ ả ủ
H ng d n gướ ẫ i iả
- S th t c a nguyên t là 11 (ô s 11) thu c chu kì 3, nhóm I trong b ng tu n hoànố ứ ự ủ ố ố ộ ả ầ
- Tên nguyên t là: Natri; Kí hi u hóa h c: Na; Nguyên t kh i: 23.ố ệ ọ ử ố
Bài 3. Các nguyên t trong nhóm I đ u là nh ng kim lo i m nh t ng t natri: tácố ề ữ ạ ạ ươ ự
d ng v i n c t o thành dung d ch ki m và gi i phóng hiđro, tác d ng v i oxi t oụ ớ ướ ạ ị ề ả ụ ớ ạ
thành oxit, tác d ng v i phi kim khác t o thành mu i ... Vi t các ph ng trình hoá h cụ ớ ạ ố ế ươ ọ
minh ho v i kali.ạ ớ
H ng d nướ ẫ gi i:ả
Các nguyên t nhóm IA, ch có hóa tr là I trong các h p ch t và có tánh ch t hóa h cố ỉ ị ợ ấ ấ ọ
t ng t natri.ươ ự
2K + 2H2O -> 2KOH + H2
4K + O2 2K2O
2K + Cl2 2KCl
Bài 4. Các nguyên t nhóm VII đ u là nh ng phi kim m nh t ng t clo (tr At): tácố ề ữ ạ ươ ự ừ
d ng v i h u h t kim lo i t o mu i, tác d ng v i hiđro t o h p ch t khí. Vi t ph ngụ ớ ầ ế ạ ạ ố ụ ớ ạ ợ ấ ế ươ
trình hoá h c minh ho v i brom.ọ ạ ớ
H ng d nướ ẫ gi i:ả
Các nguyên t nhóm VIIA có tính ch t hóa h c t ng t clo.ố ấ ọ ươ ự
Br2 + 2K 2KBr
3Br2 + 2Fe 2FeBr3
Br2 + H2 2HBr (k)
Bài 5. Hãy cho bi t cách s p x p nào sau đây đúng theo chi u tính kim lo i gi m d n :ế ắ ế ề ạ ả ầ
a) Na, Mg, Al, K
b) K, Na, Mg, Al
c) Al, K, Na, Mg
d) Mg, K, Al, Na.
Gi i thích s l a ch n.ả ự ự ọ
H ng d nướ ẫ gi i:ả
Cách s p x p đúng là b): K, Na, Mg, Al.ắ ế
Vì:
- Các nguyên t Na, Mg, AI cùng chu kìố ở , theo chi u tăng d n đi n tích h t nhân, tínhề ầ ệ ạ
kim lo i gi m. ạ ả
- Nguyên t Na, K cùng m t nhómố ở ộ , theo chi u tăng đi n tích h t nhân, tính kim lo iề ệ ạ ạ
tăng.
Bài 6. Hãy s p x p các nguyên t sau theo chi u tính phi kim tăng d n: F, O, N, P, As.ắ ế ố ề ầ
Gi i thích.ả
H ng d nướ ẫ gi i:ả
V trí các nguyên t trên trong b ng tu n hoàn:ị ố ả ầ
Theo chu kì 2, tính phi kim tăng d n t N, O, F.ầ ừ Theo nhóm VA, tính phi kim tăng d n tầ ừ
As, P, N.
V y: Tính phi kim tăng d n t trái sang ph i là As, P, N, O, F.ậ ầ ừ ả
Bài 7.
a) Hãy xác đ nh công th c c a h p ch t khí A, bi t r ng ị ứ ủ ợ ấ ế ằ
- A là oxit c a l u huỳnh ch a 50% oxi.ủ ư ứ
- 1 gam khí A chi m th tích là 0,35 lít đktc.ế ề ở
b) Hoà tan 12,8 gam h p ch t khí A vào 300 ml dung d ch NaOH 1,2M. Hãy cho bi tợ ấ ị ế
mu i nào thu đ c sau ph n ng. Tính n ng đ mol c a mu i (gi thi t th tích dungố ượ ả ứ ồ ộ ủ ố ả ế ể
d ch thay đ i không đáng k ).ị ổ ể
H ng d nướ ẫ gi i:ả
nA = = 0,015625 mol.
MA = = 64g
- Tìm s nguyên t S, O trong phân t A?ố ử ử
mO = 64 x = 32g => nO = = 2 mol
mS = 64 - 32 = 32g => ns = = 1 mol
Suy ra trong 1 phân t A có 1S và 2O, công th c c a A làử ứ ủ SO2
b) Khi d nẫ SO2 vào dung d ch NaOH và SOị2, có th t o thành mu i trung hoà, mu i axitể ạ ố ố
ho c c hai mu i:ặ ả ố
có thể bạn quan tâm

Hướng dẫn giải bài tập sách giáo khoa Hóa học lớp 10: Luyện tập bảng t...
5
865
356
Giải bài tập các môn
5
(New)

Tóm tắt lý thuyết và hướng dẫn giải bài tập SGK Hóa học 10: Bảng tuần...
5
818
362
Giải bài tập các môn
5
(New)

Hướng dẫn giải bài tập sách giáo khoa Học học lớp 10: Ý nghĩa của bảng...
3
690
318
Giải bài tập các môn
3
(New)

HÓA HỌC TÌM HIỂU VỀ BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC (T1)
3
1.105
357
Giáo án, bài giảng lớp 10
3
(New)

HÓA HỌC TÌM HIỂU VỀ BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC (T2
2
907
342
Giáo án, bài giảng lớp 10
2
(New)

Tóm tắt lý thuyết và hướng dẫn giải bài tập hóa học 10: Sự biến đổi tu...
4
804
367
Giải bài tập các môn
4
(New)
Tóm tắt lý thuyết và hướng dẫn giải bài tập SGk Hóa học 10: Sự biến đổ...
5
709
361
Giải bài tập các môn
5
(New)

BẢNG TUẦN HOÀN HÓA HỌC
2
992
364
Giáo án, bài giảng lớp 10
2
(New)
thông tin tài liệu
Giải bài tập Hóa lớp 9: Sơ lược về bảng tuần hoàn các nguyên tố hoá học
I. Tóm tắt kiến thức cơ bản: Sơ lược về bảng tuần hoàn các nguyên tố hoá học
1. Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn
Trong bảng tuần hoàn, các nguyên tố được sắp xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử.
2. Cấu tạo bảng tuần hoàn
a. Ô nguyên tố
Ô nguyên tố cho biết: Số hiệu nguyên tử, kí hiệu hóa học, tên nguyên tố, nguyên tử khối của nguyên tố đó'
b. Chu kì
- Chu kì là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron và được xếp theo chiều điện tích hạt nhân tăng dần.
- Số thứ tự chu kì bằng số lớp electron.
- Bảng tuần hoàn hiện có 7 chu kì, các chu kì 1, 2, 3 là chu kì nhỏ; các chu kì 4, 5, 6, 7 là chu kì lớn.
c. Nhóm
- Nhóm gồm các nguyên tố mà nguyên tử của chúng có số electron lớp ngoài cùng bằng nhau, do đó có tính chât tương tự nhau.
- Mỗi nhóm được xếp thành một cột theo chiều tăng của điện tích hạt nhân. Bảng tuần hoàn có 8 nhóm A và 8 nhóm B. Nhóm IA (trừ H) là các kim loại mạnh, gọi là các kim loại kiềm; Nhóm VIIA là các phi kim mạnh, gọi là nhóm halogen; Nhóm VIIIA là các khí hiếm (hay khí trơ).
- Số thứ tự của các nhóm A bằng số electrdn ở lớp ngoài cùng của nguyên tử trong nhóm đó.
Mở rộng để xem thêm
tài liệu mới trong mục này
tài liệu hot trong mục này
tài liệu giúp tôi
Nếu bạn không tìm thấy tài liệu mình cần có thể gửi yêu cầu ở đây để chúng tôi tìm giúp bạn!
xem nhiều trong tuần
70 câu hỏi trắc nghiệm luyện thi chứng chỉ tin A
Đề thi và lời giải môn xác suất thống kê của trường Học viện ngân hàng
Địa lý 12 Phát triển cây công nghiệp lâu năm Tây Nguyên
Giáo trình Quản trị học của Đại học kinh tế quốc dân
Tiểu luận: Vị trí, vai trò, nhiệm vụ của người Đảng viên với ĐCSVN- Phấn đấu, rèn luyện và tuyên truyền nhân dân của người Đảng viên
Bài tập nâng cao Tiếng Việt lớp 2: Chính tả
yêu cầu tài liệu
Giúp bạn tìm tài liệu chưa có
×



