
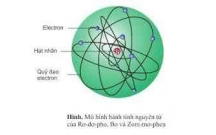
HÓA HỌC TÌM HIỂU VỀ CẤU HÌNH ELECTRON
CẤU HÌNH ELECTRON CỦA NGUYÊN TỬ
I. Mục tiêu: Quy luật sắp xếp các electron trong vỏ nguyên tử của các nguyên
tố.
II. Trọng tâm: Cấu hình electron.
III.Chuẩn bị: Sơ đồ phân bố mức năng lượng của các lớp và các phân lớp.
IV. Hoạt động dạy học:
Hoạt động của giáo viên và học sinh Nội dung
Hoạt động 1: Tìm hiểu về thứ tự các mức
năng lượng trong nguyên tử.
GV treo lên bảng Sơ đồ phân bố mức nl
của các lớp và các phân lớp và hướng dẫn
HS.
* GV: Kết luận về sự phân bố các electron
trong nguyên tử.
- Các electron trong nguyên tử ở trạng thái
cơ bản lần lượt chiếm các mức nl từ thấp
đến cao.
-Mức nl của các lớp tăng theo thứ tự từ 1
đến 7 kể từ gần hạt nhân nhất và của phân
lớp tăng theo thứ tự s, p, d, f.
Hoạt động 2: Tìm hiểu cấu hình electron
của nguyên tử.
* GV hướng dẫn HS dạng chung của cấu
hình e: nla
* GV hướng dẫn HS các bước viết cấu
hình electron và đưa ra các VD để HS vận
dụng , GV theo dõi chữa bài và củng cố
kiến thức
GV yêu cầu HS viết cấu hình electron
nguyên tử của nguyên tố: Ne (Z=10),
Cl (Z=17)
Sau khi HS viết xong cấu hình electron
nguyên tử của 1 số nguyên tố, GV nhận
xét rút kinh nghiệm
GV hướng cẫn HS cách viết gọn: neon là
khí hiếm gần nhất đứng trước clo, nên ta
I- THỨ TỰ CÁC MỨC NĂNG LƯỢNG
TRONG NGUYÊN TỬ:
- Các electron trong nguyên tử lần lượt chiếm
các mức năng lượng từ thấp đến cao và sắp xếp
từ trong ra ngoài.(Tính từ hạt nhân).
E1< E2<E3<E4
Trong các lớp: Các e lần lượt chiếm các phân
lớp là s, p, d, f…
Thứ tự sắp xếp theo mức năng lượng:
1s 2s 3s 3p 4s 3d 4p 5s ...
II- CẤU HÌNH ELECTRON CỦA NGUYÊN
TỬ
1. Cấu hình electron của nguyên tử
- Là cách để mô tả sự xắp sếp các e trong
nguyên tử: Thuộc AO nào, phân lớp nào, lớp
nào.
- Cách biểu diễn cấu hình (dạng chữ số): nla
Trong đó:
n: STT của lớp.
l: tên phân lớp.
a: Số e có mặt tại phân lớp và lớp tương ứng
VD: 1s1
có thể viết gọn:
2 5
3 3Ne s p
GV cung cấp: electron cuối cùng của
nguyên tử clo điền vào phân lớp p, người
ta gọi clo là nguyên tố p.
GV cho vd: viết cấu hình electron nguyên
tử của nguyên tố: Ar (Z=18), Fe (Z=56)
GV hướng dẫn:
-các electron của nguyên tử Fe được phân
bố như sau:
2 2 6
1 2 2s s p
2
3 3 6s p
2 6
4 3s d
nhưng cấu hình electron là cách biểu diễn
sự phân bố electron trên các lớp và các
phân lớp.
GV: Trong các cấu hình electron nguyên
tử của các nguyên tố trên hãy xác định
xem các nguyên tố đó thuộc nguyên tố s
hay p hay d?
GV hỏi:
? thế nào là nguyên tố họ s, p, d, f?
Hoạt động 3: Tìm hiểu cấu hình electron
nguyên tử của 20 nguyên tố đầu.
GV cho HS biết người ta còn có thể viết
cấu hình electron theo lớp.
GV cho HS xem SGK.
Hoạt động 4: Nghiên cứu đặc điểm của
lớp electron ngoài cùng.
-GV hd HS nghiên cứu bảng Cấu hình
electron nguyên tử của 20 nguyên tố đầu
để tìm xem
? lớp ngoài cùng của tất cả các nguyên tố
có tối đa là bao nhiêu electron?
? neon là nguyên tố khí hiếm, nó có bao
nhiêu electron ở lớp ngoài cùng?
GV đvđ: Các nguyên tử có 8 electron ở
lớp ngoài cùng (ns2np6) và nguyên tử heli
(1s2)
GV yêu cầu HS giải thích tại sao?
-GV cho HS tìm xem những kim loại như:
Na, Mg, Al, K, Ca có bao nhiêu electron ở
lớp nc?
? các nguyên tử kim loại thường có bao
nhiêu electron ở lớp ngoài cùng?
* Các bước viết cấu hình electron:
- Xác định số electron của nguyên tử.
- Điền e vào các phân lớp theo thứ tự mức năng
lượng . (Chú ý đến số e tối đa cho các phân lớp)
VD :
Ne (Z=10):
2 2 6
1 2 2s s p
Cl (Z=17):
2 2 6
1 2 2s s p
2 5
3 3s p
Ar (Z=18):
2 2 6
1 2 2s s p
2
3 3 6s p
Hoặc viế gọn:
2 6
3 3Ne s p
Fe (Z=26):
2 2 6
1 2 2s s p
2
3 3 6s p
6 2
3 4d s
Hoặc viế gọn:
6 2
3 4Ar d s
* Nguyên tố họ s, họ p, họ d:
-e cuối cùng điền vào phân lớp nào thì nguyên
tố là họ đấy:
VD: Ar là nguyên tố p
Fe là nguyên tố d vì electron cuối cùng của Fe
điền vào phân lớp d.
2. Cấu hình electron nguyên tử của 20
nguyên tố đầu
-SGK.
- Nhận xét: Các nguyên tố đều họ s và p
3. Đặc điểm của electron lớp ngoài cùng
- Đối với tất cả các nguyên tố, lớp ngoài cùng có
nhiều nhất là 8 electron (khơng tham gia vo cc
phản ứng hố học (trừ một số đk đặc biệt)) .
Khí hiếm (Trừ He có 2e LNC)
-Kim loại: 1, 2, 3 lớp ngoài cùng
-Phi kim: 5, 6, 7 electron ở lớp ngoài cùng
- Nguyên tử có 4 electron ngoài cùng có thể là
nguyên tử của nguyên tố kim loại hoặc phi kim.
GV nói thêm: (trừ H, He và B). Các
nguyên tử có 1, 2, 3 electron lớp ngoài
cùng dễ nhường electron
-GV cho HS tìm xem những phi kim như:
N, O, F, P, S, Cl có bao nhiêu electron ở
lớp nc?
? các nguyên tử phi kim thường có bao
nhiêu electron ở lớp ngoài cùng?
GV Các nguyên tử có 5, 6, 7 electron lớp
ngoài cùng dễ nhận electron
4. Củng cố bài:
* Cấu hình e nguyên tử nào sau đây viết sai:
A. 1s22s22p5 B. 1s22s22p6 C. 1s22s22p53s1 D. A. 1s22s22p63s13d54s2
* Trong cấu hình e sau:
2 2 6
1 2 2s s p
2
3 3 6s p
6 2
3 4d s
e cuối cùng được điền vào
phân lớp nào ?
* Hãy cho biết cấu hình e nào sau đây là của khí hiếm? kim loại ? phi kim?
1s22s22p6;
2 2 6
1 2 2s s p
2
3 3 6s p
6 2
3 4d s
; 1s22s22p5; 1s22s22p63s1
* Viết cấu hình e của các nguyên tử có điện tích hạt nhân Z bằng : 18, 21, 24,
29 .(GV chú ý 2 cấu hình d4s2 và d9s2 )
5.Bài tập về nhà : Bài tập sgk.
Nguyên tử X có cấu hình e lớp ngoài cùng là 4s1 viết cấu hình e đầy đủ của
nguyên tử nguyên tố X
có thể bạn quan tâm
Tóm tắt lý thuyết và hướng dẫn giải bài tập SGK Hóa học 10: Cấu hình e...
4
708
325
Giải bài tập các môn
4
(New)

Tóm tắt lý thuyết và hướng dẫn giải bài tập hóa học 10: Sự biến đổi tu...
4
808
371
Giải bài tập các môn
4
(New)

Luận văn: So sánh hiệu quả kinh tế của mô hình nuôi tôm thâm canh và q...
110
866
341
Kinh tế quản lý
110
(New)

Hướng dẫn giải bài tập sách giáo khoa Hóa học lớp 10: Luyện tập bảng t...
5
867
359
Giải bài tập các môn
5
(New)

Luận văn: So sánh hiệu quả kinh tế giữa mô hình trồng lúa 3 vụ và 2 vụ...
95
885
440
Báo cáo, luận văn khác
95
(New)

Tài liệu ôn tập môn Hóa học: TỔNG HỢP CÁC BÀI TẬP BẢO TOÀN ELECTRON
13
1.038
449
Tài liệu, đề thi Hóa Học
13
(New)
Hướng dẫn Giải bài tập Sách bài tập Vật lý 11 bài 2: Thuyết electron –...
4
970
600
Giải bài tập các môn
4
(New)

TÌM HIỂU TỔNG QUAN VỀ MẠNG TRUYỀN HÌNH CÁP VÀ NÊU CÁC LOẠI DỊCH VỤ VIỄ...
34
1.134
587
Kỹ thuật
34
(New)
thông tin tài liệu
HÓA HỌC TÌM HIỂU VỀ CẤU HÌNH ELECTRON
THỨ TỰ CÁC MỨC NĂNG LƯỢNG TRONG NGUYÊN TỬ:
- Các electron trong nguyên tử lần lượt chiếm các mức năng lượng từ thấp đến cao và sắp xếp từ trong ra ngoài.(Tính từ hạt nhân).
E1< E2
Mở rộng để xem thêm
từ khóa liên quan
tài liệu mới trong mục này
tài liệu hot trong mục này
tài liệu giúp tôi
Nếu bạn không tìm thấy tài liệu mình cần có thể gửi yêu cầu ở đây để chúng tôi tìm giúp bạn!
xem nhiều trong tuần
Địa lý 12 Phát triển cây công nghiệp lâu năm Tây Nguyên
Đề thi và lời giải môn xác suất thống kê của trường Học viện ngân hàng
Giáo trình Quản trị học của Đại học kinh tế quốc dân
MẪU GIẤY THI A4
MẪU GIỚI THIỆU CHUYỂN SINH HOẠT HỘI
Bài tập ôn tập cuối tuần lớp 2: Tuần 31
yêu cầu tài liệu
Giúp bạn tìm tài liệu chưa có
×



