
Home
Giáo án bài giảng
Giáo án, bài giảng lớp 10
HÓA HỌC TÌM HIỂU VỀ HIĐRO CLORUA, AXIT CLOHIĐRIC VÀ MUỐI CLORUA
HÓA HỌC TÌM HIỂU VỀ HIĐRO CLORUA, AXIT CLOHIĐRIC VÀ MUỐI CLORUA
HIĐRO CLORUA, AXIT CLOHIĐRIC VÀ MUỐI CLORUA
I. Mục tiêu:
- Hiđro clorua là chất khí tan nhiều trong nước và có một số tính chất riêng,
không giống với axit clohiđric (không làm đổi màu quỳ tím, không tác dụng
với đá vôi).
- Ngoài tính chất chung của axit, axit clohiđric còn có tính chất riêng là tính
khử do nguyên tố clo trong phân tử HCl có số oxi hoá thấp nhất là -1.
- Viết PTPƯ của phản ứng giữa axit clohiđric với kim loại hoạt động, oxit
bazơ, bazơ, muối.
II. Trọng tâm: Tính chất hóa học của axit Clohidric và tính chất vật lý quan
trọng của hidroclorua.
III. Chuẩn bị:
-GV: Một số hình vẽ
-HS: Xem lại bài Clo và nghiên cứu bài mới ở nhà
IV. Hoạt động dạy học:
Hoạt động của giáo viên và học sinh Nội dung
Hoạt động 1:
Hs1: BT5/SGK/trang 101
Hs2: BT 7/SGK/trang101
Hoạt động 2:
GV: yêu cầu học sinh viết công thưc
electron, CTCT của HCl và giải thích
vì sao phân tử HCl là phân tử phân
cực.
Hoạt động 3:
Hướng dẫn học sinh quan sát thí
nghiệm tính tan của hyđroclorua
Hoạt động 4:
Cho học sinh quan sát bình đựng dd
HCl bằng thủy tinh để tự học sinh rút
ra kết luận, giáo viên bổ sung thêm.
Hoạt động 5:
- Yêu cầu học sinh viết phương trình
hóa học giữa axit HCl với kim loại,
bazơ, oxit bazơ;
- Uốn nắn những sai sót cho học sinh
khi viết phương trình hóa học.
I. Hydroclorua
1. Cấu tạo phân tử
Cặp electron bị lệch về phía clo do clo có
độ âm điện lớn hơn hydro
2. Tính chất
- Hyđroclorua là chất khí, không màu,
tan nhiều trong nước (1lít nước hòa tan
500 lít HCl)
Hyđroclorua nặng hơn không khí
II. Axít Clohyđric
1. Tính chất vật lý
Học sinh nêu tính chất vật lý như
trong sách giáo khoa;
- DddHCl = 1,19 g/cm3 (370C);
- Bốc khói trong không khí.
2. Tính chất hóa học
a. Tính axit mạnh
HCl + Mg ………..…………………
HCl + FeO ………………………….
HCl + Fe(OH)3 .…………………….
HCl + CaSO3 ……+ SO2 +… …
b. Tính khử
Ví dụ:
+4 -1 +2 0
GV: nhắc lại các số oxi hoá của clo?
từ đó kết luận tính chất của axit HCl.
GV: nhắc lại nguyên tắc điều chế clo
trong phòng thí nghiệm? Nêu ví dụ?
Xác định số oxi hoá của các nguyên tố,
chất oxi hoá chất khử?
Hoạt động 6:
- GV: nêu các thí nghiệm điều chế HCl
trong phòng thí nghiệm.
- GV: hãy giải thích vì sao dùng NaCl
tt và H2SO4 đặc?
để thu được khí HCl vì khí HCl tan
rất nhiều trong nước.
- lưu ý: ở các nhiệt độ khác nhau sản
phẩm tạo thành cũng khác nhau
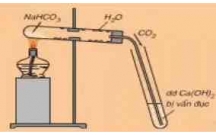
-GV: cho hs quan sát hình 5.7, gv trình
bày quy trình sản xuất HCl trong công
nghiệp
PbO2 + 4HCl PbCl2 + Cl2 + 2H2O
2
4
OMn
+ 4
1
ClH
0
t
2
2
ClMn
+
0
2
Cl
+ 2H2O
3. Điều chế
a. Trong phòng thí nghiệm
NaCl + H2SO4
C250t
00
NaHSO4 + HCl
NaCl + H2SO4
C400t
00
Na2SO4 + 2HCl
b. Trong công nghiêp (phương pháp
tổng hợp) đốt Cl2 và H2 lấy từ phương
trình điện phân dung dịch NaCl
H2 + Cl2 → 2HCl
NaCl + H2SO4 → Na2SO4 + 2HCl
- Clo hóa các hợp chất hữu cơ đặc
biệt là hyđrocacbon.
VD: C2H6 + Cl2 → C2H5Cl +
IV. Củng cố:
- Lấy các ví dụ chứng minh tính axit, tính khử của axit HCl?
- BTVN: + làm BT1, 3, 4,5 trong SGK/ trang 106
có thể bạn quan tâm

HÓA HỌC TÌM HIỂU Muối clorua và nhận biết muối clorua
1
5.743
403
Giáo án, bài giảng lớp 10
1
(New)

HÓA HỌC TÌM HIỂU VỀ AXIT SUNFURIC, MUỐI SUNFAT (T2)
2
1.211
385
Giáo án, bài giảng lớp 10
2
(New)

HÓA HỌC TÌM HIỂU VỀ AXIT SUNFURIC, MUỐI SUNFAT (T3)
2
1.088
378
Giáo án, bài giảng lớp 10
2
(New)

Tiến hành thực nghiệm phân tích hàm lượng sắt, amoni, độ cứng, clorua...
50
900
441
Kỹ thuật
50
(New)

HÓA HỌC 8 LÝ THUYẾT VÀ BÀI TẬP AXIT – BAZƠ - MUỐI
11
1.342
356
Giáo án, bài giảng lớp 8
11
(New)
Giải bài tập Hóa Học 9: Axit cacbonic và muối cacbonat
2
932
445
Giải bài tập các môn
2
(New)

Tóm tắt kiến thức cơ bản và giải bài tập Hóa học lớp 11: Axit, bazơ và...
3
1.083
342
Giải bài tập các môn
3
(New)

Tóm tắt kiến thức cơ bản và Giải bài tập Hóa học lớp 11: Axit nitric v...
4
767
320
Giải bài tập các môn
4
(New)
thông tin tài liệu
HÓA HỌC TÌM HIỂU VỀ HIĐRO CLORUA, AXIT CLOHIĐRIC VÀ MUỐI CLORUA
Hydroclorua
1. Cấu tạo phân tử
Cặp electron bị lệch về phía clo do clo có độ âm điện lớn hơn hydro
2. Tính chất
- Hyđroclorua là chất khí, không màu, tan nhiều trong nước (1lít nước hòa tan 500 lít HCl)
Hyđroclorua nặng hơn không khí
II. Axít Clohyđric
1. Tính chất vật lý
Học sinh nêu tính chất vật lý như trong sách giáo khoa;
- DddHCl = 1,19 g/cm3 (370C);
- Bốc khói trong không khí.
2. Tính chất hóa học
a. Tính axit mạnh
HCl + Mg ………..…………………
HCl + FeO ………………………….
HCl + Fe(OH)3 .…………………….
HCl + CaSO3 ……+ SO2 +… …
b. Tính khử
Ví dụ:
+4 -1 +2 0
PbO2 + 4HCl PbCl2 + Cl2 + 2H2O
+ 4 + + 2H2O
3. Điều chế
a. Trong phòng thí nghiệm
NaCl + H2SO4 NaHSO4 + HCl
NaCl + H2SO4 Na2SO4 + 2HCl
b. Trong công nghiêp (phương pháp tổng hợp) đốt Cl2 và H2 lấy từ phương trình điện phân dung dịch NaCl
H2 + Cl2 → 2HCl
NaCl + H2SO4 → Na2SO4 + 2HCl
- Clo hóa các hợp chất hữu cơ đặc biệt là hyđrocacbon.
VD: C2H6 + Cl2 → C2H5Cl
Mở rộng để xem thêm
từ khóa liên quan
tài liệu mới trong mục này
tài liệu hot trong mục này
tài liệu giúp tôi
Nếu bạn không tìm thấy tài liệu mình cần có thể gửi yêu cầu ở đây để chúng tôi tìm giúp bạn!
xem nhiều trong tuần
70 câu hỏi trắc nghiệm luyện thi chứng chỉ tin A
Đề thi và lời giải môn xác suất thống kê của trường Học viện ngân hàng
Địa lý 12 Phát triển cây công nghiệp lâu năm Tây Nguyên
Bài tập nâng cao Tiếng Việt lớp 2: Chính tả
Tiểu luận: Vị trí, vai trò, nhiệm vụ của người Đảng viên với ĐCSVN- Phấn đấu, rèn luyện và tuyên truyền nhân dân của người Đảng viên
Giáo trình Quản trị học của Đại học kinh tế quốc dân
yêu cầu tài liệu
Giúp bạn tìm tài liệu chưa có
×



