
Home
Giáo dục đào tạo
Giải bài tập các môn
Hướng dẫn giải bài tập Hóa học 9 - Thực hành: Tính chất hóa học của bazơ và muối
Hướng dẫn giải bài tập Hóa học 9 - Thực hành: Tính chất hóa học của bazơ và muối
H ng d n gi i bài t p Hóa h c 9 - Th c hành: Tính ch t hóa h c c a baz và mu iướ ẫ ả ậ ọ ự ấ ọ ủ ơ ố
Tính ch t hóa h c c a baz và mu iấ ọ ủ ơ ố
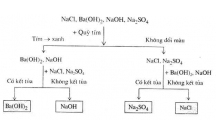
1. Tính ch t hóa h c c a baz .ấ ọ ủ ơ
Thí nghi m 1:ệ Natri hiđroxit tác d ng v i mu i.ụ ớ ố
Hi n t ng: Xu t hi n k t t a màu nâu đ .ệ ượ ấ ệ ế ủ ỏ
Gi i thích: NaOH tác d ng v i dung d ch FeClả ụ ớ ị 3 t o ra k t t a Fe(OH)ạ ế ủ 3 nâu đ .ỏ
Ph ng trình: 3NaOH + FeClươ 3 → Fe(OH)3 + NaCl.
K t lu n: Baz ki m tác d ng v i mu i t o thành baz m i và mu i m i.ế ậ ơ ề ụ ớ ố ạ ơ ớ ố ớ
Thí nghi m 2:ệ Đ ng (II) hiđroxit tác d ng v i axit.ồ ụ ớ
Hi n t ng: K t t a tan.ệ ượ ế ủ
Gi i thích: K t t a tan là do HCl tác d ng v i Cu(OH)ả ế ủ ụ ớ 2 t o dd trong su t màu xanhạ ố
lam.
Ph ng trình: Cu(OH)ươ 2 + 2HCl → CuCl2 + 2H2O.
K t lu n: Baz tác d ng v i dung d ch axit t o mu i và n c.ế ậ ơ ụ ớ ị ạ ố ướ
2. Tính ch t hóa h c c a mu i.ấ ọ ủ ố
Thí nghi m 3:ệ Đ ng (II) sunfat tác d ng v i kim lo i.ồ ụ ớ ạ
Hi n t ng: Trên đinh s t xu t hi n l p ch t r n màu đ .ệ ượ ắ ấ ệ ớ ấ ắ ỏ
Gi i thích: Fe đ y Cu ra kh i dung d ch mu i CuSOả ẩ ỏ ị ố 4. Cu bám vào trên b m t đinhề ặ
s t.ắ
Ph ng trình: Fe + CuSOươ 4 → FeSO4 + Cu.
K t lu n: Kim lo i tác d ng v i mu i t o mu i m i và gi i phóng kim lo i.ế ậ ạ ụ ớ ố ạ ố ớ ả ạ
Thí nghi m 4:ệ Bari clorua tác d ng v i mu iụ ớ ố
Hi n t ng: Xu t hi n k t t a tr ng không tan.ệ ượ ấ ệ ế ủ ắ
Gi i thích: BaClả2 tác d ng v i Naụ ớ 2SO4 t o ra BaSOạ4 màu tr ng không tan.ắ
Ph ng trình: BaClươ 2 + Na2SO4 → BaSO4 + 2NaCl.
K t lu n: Mu i tác d ng v i mu i t o thành hai mu i m i.ế ậ ố ụ ớ ố ạ ố ớ
Thí nghi m 5:ệ Bari clorua tác d ng v i axit.ụ ớ
Hi n t ng: Xu t hi n k t t a tr ng.ệ ượ ấ ệ ế ủ ắ
Gi i thích: BaClả2 tác d ng v i Hụ ớ 2SO4 t o ra k t t a tr ng BaSOạ ế ủ ắ 4.
Ph ng trình: BaClươ 2 + H2SO4 → BaSO4 + 2HCl.
K t lu n: Mu i tác d ng v i axit t o mu i m i và axit m i.ế ậ ố ụ ớ ạ ố ớ ớ
có thể bạn quan tâm

HÓA HỌC : THỰC HÀNH BAZƠ VÀ MUỐI
2
822
368
Giáo án, bài giảng lớp 9
2
(New)
Hướng dẫn Giải bài tập Hóa lớp 9: Tính chất hóa học của Bazơ
3
888
327
Giải bài tập các môn
3
(New)

Tóm tắt kiến thức cơ bản và giải bài tập Hóa học lớp 11: Axit, bazơ và...
3
1.082
341
Giải bài tập các môn
3
(New)

Hướng dẫn Giải bài tập Hóa lớp 9: Tính chất hóa học của muối
5
801
415
Giải bài tập các môn
5
(New)

Hướng dẫn giải bài tập hóa học lớp 9 Thực hành: Tính chất hóa học của...
2
760
326
Giải bài tập các môn
2
(New)

Tóm tắt kiến thức cơ bản và giải bài tập Hóa học lớp 11: Sự điện li củ...
3
811
333
Giải bài tập các môn
3
(New)

HÓA HỌC 8 LÝ THUYẾT VÀ BÀI TẬP AXIT – BAZƠ - MUỐI
11
1.342
355
Giáo án, bài giảng lớp 8
11
(New)

Hướng dẫn Giải bài tập sách giáo khoa Toán lớp 8: Tính chất cơ bản của...
4
1.171
309
Tài liệu, đề thi môn Toán
4
(New)
thông tin tài liệu
Tính chất hóa học của bazơ và muối
1. Tính chất hóa học của bazơ.
Thí nghiệm 1: Natri hiđroxit tác dụng với muối.
Hiện tượng: Xuất hiện kết tủa màu nâu đỏ.
Giải thích: NaOH tác dụng với dung dịch FeCl3 tạo ra kết tủa Fe(OH)3 nâu đỏ.
Phương trình: 3NaOH + FeCl3 → Fe(OH)3 + NaCl.
Kết luận: Bazơ kiềm tác dụng với muối tạo thành bazơ mới và muối mới.
Thí nghiệm 2: Đồng (II) hiđroxit tác dụng với axit.
Hiện tượng: Kết tủa tan.
Giải thích: Kết tủa tan là do HCl tác dụng với Cu(OH)2 tạo dd trong suốt màu xanh lam.
Phương trình: Cu(OH)2 + 2HCl → CuCl2 + 2H2O.
Kết luận: Bazơ tác dụng với dung dịch axit tạo muối và nước.
2. Tính chất hóa học của muối.
Thí nghiệm 3: Đồng (II) sunfat tác dụng với kim loại.
Hiện tượng: Trên đinh sắt xuất hiện lớp chất rắn màu đỏ.
Giải thích: Fe đẩy Cu ra khỏi dung dịch muối CuSO4. Cu bám vào trên bề mặt đinh sắt.
Phương trình: Fe + CuSO4 → FeSO4 + Cu.
Kết luận: Kim loại tác dụng với muối tạo muối mới và giải phóng kim loại.
Thí nghiệm 4: Bari clorua tác dụng với muối
Hiện tượng: Xuất hiện kết tủa trắng không tan.
Giải thích: BaCl2 tác dụng với Na2SO4 tạo ra BaSO4 màu trắng không tan.
Phương trình: BaCl2 + Na2SO4 → BaSO4 + 2NaCl.
Kết luận: Muối tác dụng với muối tạo thành hai muối mới.
Thí nghiệm 5: Bari clorua tác dụng với axit.
Mở rộng để xem thêm
tài liệu mới trong mục này
tài liệu hot trong mục này
tài liệu giúp tôi
Nếu bạn không tìm thấy tài liệu mình cần có thể gửi yêu cầu ở đây để chúng tôi tìm giúp bạn!
xem nhiều trong tuần
CHÍNH SÁCH PHÁT TRIỂN: Bài 3 - Lý thuyết phát triển
Hướng dẫn cài đặt và sử dụng XP Mode trên Windows 7
Cách tạo bookmark trong Word 2016
Bạn đã biết sạc pin đúng cách khi mới mua điện thoại về chưa?
Hướng dẫn thiết kế Monogram với Adobe Illustrator
Giải bài tập SBT Tiếng Anh lớp 7 Unit 12: An Overcrowded World
yêu cầu tài liệu
Giúp bạn tìm tài liệu chưa có
×



