
Home
Giáo dục đào tạo
Giải bài tập các môn
Hướng dẫn Giải bài tập Hóa lớp 9: Tính chất hóa học của Bazơ
Hướng dẫn Giải bài tập Hóa lớp 9: Tính chất hóa học của Bazơ
H ng d n Gi i bài t p Hóa l p 9: Tính ch t hóa h c c a Bazướ ẫ ả ậ ớ ấ ọ ủ ơ
Bài 1. (Trang 25 SGK Hóa 9)
a) Có ph i t t c các ch t ki m đ u là baz không? D n ra công th c hóa h c c a baả ấ ả ấ ề ề ơ ẫ ứ ọ ủ
ch t đ ki m đ minh h a.ấ ể ề ể ọ
b) Có ph i t t c các baz đ u là ch t ki m không? D n ra công th c hóa h c c a baả ấ ả ơ ề ấ ề ẫ ứ ọ ủ
ch t đ ki m đ minh h a.ấ ể ề ể ọ
H ng d n gi i bài 1:ướ ẫ ả
a) Vì ki m là m t lo i baz tan đ c trong n c nên t t c các ch t ki m đ u là baz .ề ộ ạ ơ ượ ướ ấ ả ấ ề ề ơ
Thí d : NaOH, KOH, Ba(OH)ụ2.
b) Vì không ph o m i baz đ u tan trong n c nên không ph i t t c các baz đ u làả ọ ơ ề ướ ả ấ ả ơ ề
ch t ki m.ấ ề
Thí d : Các baz Cu(OH)ụ ơ 2, Mg(OH)2, Fe(OH)3 ..không ph i là ch t ki m.ả ấ ề
Bài 2. (Trang 25 SGK Hóa 9)
Có nh ng baz sau: Cu(OH)ữ ơ 2, NaOH, Ba(OH)2. Hãy cho bi t nh ng baz nàoế ữ ơ
a) Tác d ng đ c v i v i dung d ch HCl. b) B nhi t phân h y.ụ ượ ớ ớ ị ị ệ ủ
c) Tác d ng đ c COụ ượ 2. d) Đ i màu quỳ tím. thành xanh.ổ
H ng d n gi i bài 2:ướ ẫ ả
a) T t c các baz đ u tác d ng v i axit HCl:ấ ả ơ ề ụ ớ
Cu(OH)2 + 2HCl → CuCl2 + 2H2O
NaOH + HCl → NaCl + H2O
Ba(OH)2 + 2HCl → BaCl2 + 2H2O
b) Ch có Cu(OH)ỉ2 là baz không tan nên b nhi t phân h y:ơ ị ệ ủ
Cu(OH)2 → CuO + H2O
c) Nh ng baz tác d ng v i COữ ơ ụ ớ 2 là NaOH và Ba(OH)2.
NaOH + CO2 → Na2CO3 + H2O
Ba(OH)2 + CO2 → BaCO3 + H2O
d) Nh ng baz đ i màu quỳ tím thành màu xanh là NaOH và Ba(OH)ữ ơ ổ 2.
Bài 3. (Trang 25 SGK Hóa 9)
T nh ng ch t có s n là Naừ ữ ấ ẵ 2O, CaO, H2O. Hãy vi t các ph ng trình hóa h c đi u chế ươ ọ ề ế
các dung d ch baz .ị ơ
H ng d n gi i bài 3:ướ ẫ ả
Ph ng trình hóa h c đi u ch các dung d ch baz :ươ ọ ề ế ị ơ
Na2O + H2O → 2NaOH
CaO + H2O → Ca(OH)2
Bài 4. (Trang 25 SGK Hóa 9)
Có 4 l không nhãn, m i l đ ng m t dung d ch không màu sau: NaCl, Ba(OH)ọ ỗ ọ ự ộ ị 2,
NaOH, Na2SO4. Ch đ c dùng quỳ tím, làm th nào nh n bi t dung d ch đ ng trongỉ ượ ế ậ ế ị ự
m i l b ng ph ng pháp hóa h c? Vi t các ph ng trình hóa h c.ỗ ọ ằ ươ ọ ế ươ ọ
H ng d n gi i bài 4:ướ ẫ ả
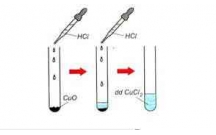
L y t m i l m t m u hóa ch t (g i là m u th ) đ làm thí nghi m nh n bi t.ấ ừ ỗ ọ ộ ẫ ấ ọ ẫ ử ể ệ ậ ế
Cho quỳ tím vào m u th t ng ch t và quan sát, th y:ẫ ử ừ ấ ấ
– Nh ng dung d ch làm quỳ tím đ i màu là: NaOH và Ba(OH)ữ ị ổ 2, (nhóm 1).
– Nh ng dung d ch không làm quỳ tím đ i màu là: NaCl, Naữ ị ổ 2SO4 (nhóm 2).
Đ nh n ra t ng ch t trong m i nhóm, ta l y m t ch t nhóm (1), l n l t cho vàoể ậ ừ ấ ỗ ấ ộ ấ ở ầ ượ
m i ch t nhóm (2), n u có k t t a xu t hi n thì ch t l y nhóm (1) là Ba(OH)ỗ ấ ở ế ế ủ ấ ệ ấ ấ ở 2 và
ch t nhóm (2) là Naấ ở 2SO4. T đó nh n ra ch t còn l i m i nhóm.ừ ậ ấ ạ ở ỗ
Ph ng trình ph n ng: Ba(OH)ươ ả ứ 2 + Na2SO4 → BaSO4 + NaOH
Ho c các em xem theo s đ h ng d n sauặ ơ ồ ướ ẫ
Bài 5. (Trang 25 SGK Hóa 9)
Cho 15,5 gam natri oxit Na2O tác d ng v i n c, thu đ c 0,5 lít dung d ch baz .ụ ớ ướ ượ ị ơ
a) Vi t ph ng trình hóa h c và tính n ng đ mol c a dung d ch baz thu đ c.ế ươ ọ ồ ộ ủ ị ơ ượ
b) Tính th tích dung d ch Hể ị 2SO4 20% có kh i l ng riêng 1,14 g/ml c n dùng đ trungố ượ ầ ể
hòa dung d ch baz nói trên.ị ơ
H ng d n gi i bài 5:ướ ẫ ả
S mol Naố2O = 15,5:62 = 0,25 mol
a) Khi cho Na2O x y ra ph n ng, t o thành ph n ng dung d ch có ch t tan là NaOH.ả ả ứ ạ ả ứ ị ấ
Na2O + H2O → 2NaOH
0,25 → 0,5 (mol)
500 ml = 500/1000= 0,5 lít; CM, NaOH = 0,5/0,5 = 1M.
b) Ph ng trình ph n ng trung hòa dung d ch:ươ ả ứ ị
2NaOH + H2SO4 → Na2SO4 + 2H2O
P 0,5 → 0,25 0,25 (mol)ứ
mH2SO4 = 0,25×98 = 24,5 g
mdd H2SO4 = 24,5.100/20= 122,5 g
mdd, ml = mdd,g = Dg/ml = 122,5/1,14 ≈ 107,5 ml
có thể bạn quan tâm

Hướng dẫn giải bài tập Hóa học 9 - Thực hành: Tính chất hóa học của ba...
2
869
346
Giải bài tập các môn
2
(New)

Tóm tắt kiến thức cơ bản và giải bài tập Hóa học lớp 11: Sự điện li củ...
3
819
338
Giải bài tập các môn
3
(New)

Hướng dẫn Giải bài tập Hóa học lớp 11: Luyện tập tính chất của nitơ, p...
4
850
317
Giải bài tập các môn
4
(New)
Hướng dẫn Giải bài tập Hóa lớp 9: Một số Bazơ quan trọng
2
778
323
Giải bài tập các môn
2
(New)
Hướng dẫn Giải bài tập Hóa lớp 9: Tính chất hóa học của oxit
3
738
375
Giải bài tập các môn
3
(New)

Hướng dẫn Giải bài tập SGK Hóa lớp 9: Tính chất hóa học của axit
3
756
340
Giải bài tập các môn
3
(New)

Hướng dẫn Giải bài tập Hóa lớp 9: Tính chất hóa học của muối
5
806
419
Giải bài tập các môn
5
(New)

Hướng dẫn Giải bài tập Hóa lớp 9: Tính chất vật lý của kim loại
3
790
352
Giải bài tập các môn
3
(New)
thông tin tài liệu
Bài 1. (Trang 25 SGK Hóa 9)
a) Có phải tất cả các chất kiềm đều là bazơ không? Dẫn ra công thức hóa học của ba chất để kiềm để minh họa.
b) Có phải tất cả các bazơ đều là chất kiềm không? Dẫn ra công thức hóa học của ba chất để kiềm để minh họa.
Hướng dẫn giải bài 1:
a) Vì kiềm là một loại bazơ tan được trong nước nên tất cả các chất kiềm đều là bazơ.
Thí dụ: NaOH, KOH, Ba(OH)2.
b) Vì không phảo mọi bazơ đều tan trong nước nên không phải tất cả các bazơ đều là chất kiềm.
Thí dụ: Các bazơ Cu(OH)2, Mg(OH)2, Fe(OH)3 ..không phải là chất kiềm.
Mở rộng để xem thêm
tài liệu mới trong mục này
tài liệu hot trong mục này
tài liệu giúp tôi
Nếu bạn không tìm thấy tài liệu mình cần có thể gửi yêu cầu ở đây để chúng tôi tìm giúp bạn!
xem nhiều trong tuần
Địa lý 12 Phát triển cây công nghiệp lâu năm Tây Nguyên
Đề thi và lời giải môn xác suất thống kê của trường Học viện ngân hàng
Giáo trình Quản trị học của Đại học kinh tế quốc dân
MẪU GIẤY THI A4
MẪU GIỚI THIỆU CHUYỂN SINH HOẠT HỘI
Bài tập ôn tập cuối tuần lớp 2: Tuần 31
yêu cầu tài liệu
Giúp bạn tìm tài liệu chưa có
×



