
Home
Giáo dục đào tạo
Giải bài tập các môn
Hướng dẫn Giải bài tập Hóa lớp 9: Tính chất hóa học của muối
Hướng dẫn Giải bài tập Hóa lớp 9: Tính chất hóa học của muối
H ng d n Gi i bài t pướ ẫ ả ậ Hóa l p 9ớ: Tính ch t hóa h c c a mu iấ ọ ủ ố
A. Tóm t t ki n th c Tính ch t hóa h c c a mu iắ ế ứ ấ ọ ủ ố
I. Tính ch t hóa h c c a mu iấ ọ ủ ố
1. Tác d ng v i kim lo iụ ớ ạ
Dung d ch mu i có th tác d ng v i kim lo i t o thành mu i m i và kim lo i m i.ị ố ể ụ ớ ạ ạ ố ớ ạ ớ
Thí d : Fe + CuSOụ4 → FeSO4 + Cu↓
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag↓
2. Tác d ng v i axitụ ớ
Mu i có th tác d ng đ c v i axit t o thành mu i m i và axit m i.ố ể ụ ượ ớ ạ ố ớ ớ
Thí d : BaClụ2 + H2SO4 → 2HCl + BaSO4↓
CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O
3. Tác d ng v i dung d ch mu iụ ớ ị ố
Hai dung d ch mu i có th tác d ng v i nhau t o thành hai mu i m i.ị ố ể ụ ớ ạ ố ớ
Thí d : AgNOụ3 + NaCl → NaNO3 + AgCl↓
4. Tác d ng v i dung d ch bazụ ớ ị ơ
Dung d ch baz có th tác d ng v i dung d ch baz t o thành mu i m i và bazị ơ ể ụ ớ ị ơ ạ ố ớ ơ
m i.ớ
Thí d : Naụ2CO3 + Ba(OH)2 → 2NaOH + BaCO3↓
5. Ph n ng phân h y mu iả ứ ủ ố
Nhi u mu i b phân h y nhi t đ cao nh : KClOề ố ị ủ ở ệ ộ ư 3, KMnO4, CaCO3,…
Thí d :ụ 2KClO3 → 2KCl + 3O2
CaCO3 → CaO + CO2
II. Ph n ng trao đ i trong dung d chả ứ ổ ị
1. Đ nh nghĩa: Ph n ng trao đ i là ph n ng hóa h c, trong đó hai h p ch t thamị ả ứ ổ ả ứ ọ ợ ấ
gia ph n ng trao đ i v i nhay nh ng thành ph n c u t o c a chúng đ t o raả ứ ổ ớ ữ ầ ấ ạ ủ ể ạ
nh ng h p ch t m i.ữ ợ ấ ớ
2. Đi u ki n x y ra ph n ng trao đ iề ệ ả ả ứ ổ
Ph n ng trao đ i trong dung d ch c a các ch t ch x y ra n u s n ph m t o thànhả ứ ổ ị ủ ấ ỉ ả ế ả ẩ ạ
có ch t không tan ho c ch t khí.ấ ặ ấ
Thí d : CuSOụ4 + 2NaOH → Na2SO4 + Cu(OH)2↓
K2SO4 + NaOH: Ph n ng không x y ra.ả ứ ả
Chú thích: ph n ng trung hòa cũng thu c lo i ph n ng trao đ i và luôn x y ra.ả ứ ộ ạ ả ứ ổ ả
Thí d : Hụ2SO4 + 2NaOH → Na2SO4 + 2H2O
B. Gi i bài t p SGK trang 33 hóa 9:ả ậ
Bài 1. (Trang 33 Hóa 9 ch ng 1)ươ
Hãy d n ra m t dung d ch mu i khi tác d ng v i m t dung d ch ch t khác thì t oẫ ộ ị ố ụ ớ ộ ị ấ ạ
ra:
a) Ch t khí;ấ b) Ch t k t t a.ấ ế ủ
Vi t ph ng trình hóa h c.ế ươ ọ
H ng d n gi i bài 1:ướ ẫ ả
a) Ta ch n các mu i cacbonat ho c mu i sunfit tác d ng v i axit m nh.ọ ố ặ ố ụ ớ ạ
Thí d : CaCOụ3 + HCl → CaCl2 + CO2↑ + H2O
Na2SO3 + H2SO4 → Na2SO4 + SO2↑ + H2O
b) Ta d a vào b ng tính tan c a mu i đ ch n các mu i không tan (BaSOự ả ủ ố ể ọ ố 4, AgCl,
BaCO3…) ho c baz không tan, t đó tìm ra mu i và ch t tham gia ph n ng cònặ ơ ừ ố ấ ả ứ
l i, thí d :ạ ụ
BaCl2 + H2SO4 → 2HCl + BaSO4↓
Na2CO3 + Ba(NO3)2 → 2NaNO3 + BaCO3↓
CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4↓
Bài 2. (Trang 33 Hóa 9 ch ng 1)ươ
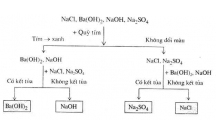
Có 3 l không nhãn, m i l đ ng m t dung d ch mu i: CuSOọ ỗ ọ ự ộ ị ố 4, AgNO3, NaCl. Hãy
dùng nh ng dung d ch có s n trong phòng thí nghi m đ nh n bi t ch t đ ng trongữ ị ẵ ệ ể ậ ế ấ ự
m i l . Vi t các ph ng trình hóa h c.ỗ ọ ế ươ ọ
H ng d n gi i bài 2:ướ ẫ ả
Dùng dung d ch NaCl t pha ch đ nh n bi t dung d ch AgNOị ự ế ể ậ ế ị 3
Dùng dung d ch NaOH trong phòng thí nghi m đ nh n bi t dung d chị ệ ể ậ ế ị
CuSO4 màu xanh lam
Dung d ch còn l i trong l không nhãn là dung d ch NaClị ạ ọ ị
Bài 3. (Trang 33 Hóa 9 ch ng 1)ươ
Có nh ng dung d ch mu i sau: Mg(NOữ ị ố 3)2, CuCl2. Hãy cho bi t mu i nào có th tácế ố ể
d ng v i:ụ ớ
a) Dung d ch NaOH;ị b) Dung d ch HCl;ị c) Dung d ch AgNOị3.
N u có ph n ng, hãy vi t các ph ng trình hóa h c.ế ả ứ ế ươ ọ
H ng d n gi i bài 3:ướ ẫ ả
a) C hai mu i tác d ng v i dung d ch NaOH vì s n ph m t o thành có Mg(OH)ả ố ụ ớ ị ả ẩ ạ 2,
Cu(OH)2 không tan,
Mg(NO3)2 + 2NaOH → 2NaNO3 + Mg(OH)2↓
CuCl2 + 2NaOH → 2NaCl + Cu(OH)2↓
b) Không có mu i nào tác d ng v i dung d ch HCl vì không có ch t k t t a hayố ụ ớ ị ấ ế ủ
ch t khí t o thành.ấ ạ
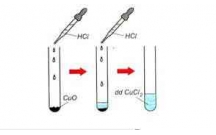
c) Ch có mu i CuClỉ ố 2 tác d ng v i dung d ch AgNOụ ớ ị 3 vì s n ph m t o thành có AgClả ẩ ạ
không tan.
CuCl2 + 2AgNO3 → 2AgCl↓ + Cu(NO3)2
Bài 4. (Trang 33 Hóa 9 ch ng 1)ươ
Cho nh ng dung d ch mu i sau đây ph n ng v i nhau t ng đôi m t, hãy ghi d uữ ị ố ả ứ ớ ừ ộ ấ
(x) n u có ph n ng, d u (0) n u không.ế ả ứ ấ ế
Na2CO3KCl Na2SO4NaNO3
Pb(NO3)2
BaCl2
Vi t ph ng trình hóa h c ô có d u (x).ế ươ ọ ở ấ
H ng d n gi i bài 4:ướ ẫ ả
Na2CO3KCl Na2SO4NaNO3
Pb(NO3)2x x x 0
BaCl2x 0 x 0
Ph ng trình hóa h c c a các ph n ng:ươ ọ ủ ả ứ
Pb(NO3)2 + Na2CO3 → 2NaNO3 + PbCO3↓
Pb(NO3)2 + 2KCl → 2KNO3 + PbCl2↓
Pb(NO3)2 + Na2SO4 → 2NaNO3 + PbSO4↓
BaCl2 + Na2CO3 → 2NaCl + BaCO3↓
BaCl2 + Na2SO4 → 2NaCl + BaSO4↓
Bài 5. (Trang 33 Hóa 9 ch ng 1)ươ
Ngâm m t đinh s t s ch trong dung d ch (II) sunfat. Câu tr l i nào sau đây là đúngộ ắ ạ ị ả ờ
nh t cho hi n t ng quan sát đ c?ấ ệ ượ ượ
a) Không có hi n t ng nào x y ra.ệ ượ ả
b) Kim lo i đ ng màu đ bám ngoài đinh s t, đinh s t không có s thay đ i.ạ ồ ỏ ắ ắ ự ổ
c) M t ph n đinh s t b hòa tan, kim lo i đ ng bám ngoài đinh s t và màu xanh lamộ ầ ắ ị ạ ồ ắ
c a dung d ch ban đ u nh t d n.ủ ị ầ ạ ầ
d) Không có ch t m i nào đ c sinh ra, ch có m t ph n đinh s t b hòa tan.ấ ớ ượ ỉ ộ ầ ắ ị
Gi i thích cho s l a ch n và vi t ph ng trình hóa h c n u có.ả ự ự ọ ế ươ ọ ế
H ng d n gi i bài 5:ướ ẫ ả
Câu c) Các em v n d ng ki n th c đã h c ho c xem ph n A đ gi i thích.ậ ụ ế ứ ọ ặ ở ầ ể ả
Bài 6. (Trang 33 Hóa 9 ch ng 1)ươ
Tr n 30ml dung d ch có ch a 2,22g CaClộ ị ứ 2 v i 70 ml dung d ch có ch a 1,7g AgNOớ ị ứ 3.
a) Hãy cho bi t hi n t ng quan sát đ c và vi t ph ng trình hóa h c.ế ệ ượ ượ ế ươ ọ
b) Tính kh i l ng ch t r n sinh ra.ố ượ ấ ắ
c) Tính n ng đ mol c a ch t còn l i trong dung d ch sau ph n ng. Cho r ng thồ ộ ủ ấ ạ ị ả ứ ằ ể
tích c a dung d ch thay đ i không đáng k .ủ ị ổ ể
H ng d n gi i bài 6:ướ ẫ ả
Ph ng trình ph n ngươ ả ứ
CaCl2 (dd) + 2AgNO3 -> 2AgCl (r) + Ca(NO3)2 (dd)
a) Hi n t ng quan sát đ c: T o ra ch t không tan, màu tr ng, l ng d n xu ngệ ượ ượ ạ ấ ắ ắ ầ ố
đáy c c đó là AgClố
b) Đáp s mốAgCl=1,435 gam
c) Trong 30 + 70 = 100 (ml) dd sau ph n ng có ch a 0,02 – 0,05 =0,015 (mol) CaClả ứ ứ 2
d và 0,005 mol Ca(NOư3)2
Do v y ta có CậMcaCl2=0,15M và CMca(NO3)2 = 0,05 M.
có thể bạn quan tâm

Hướng dẫn giải bài tập Hóa học 9 - Thực hành: Tính chất hóa học của ba...
2
864
343
Giải bài tập các môn
2
(New)

Hướng dẫn Giải bài tập Hóa học lớp 11: Luyện tập tính chất của nitơ, p...
4
840
316
Giải bài tập các môn
4
(New)
Hướng dẫn Giải bài tập Hóa lớp 9: Tính chất hóa học của oxit
3
732
371
Giải bài tập các môn
3
(New)

Hướng dẫn Giải bài tập SGK Hóa lớp 9: Tính chất hóa học của axit
3
750
336
Giải bài tập các môn
3
(New)
Hướng dẫn Giải bài tập Hóa lớp 9: Tính chất hóa học của Bazơ
3
888
327
Giải bài tập các môn
3
(New)

Hướng dẫn Giải bài tập Hóa lớp 9: Tính chất vật lý của kim loại
3
786
348
Giải bài tập các môn
3
(New)
Hướng dẫn Giải bài tập Hóa lớp 9: Tính chất hóa học của kim loại
4
791
327
Giải bài tập các môn
4
(New)

Hướng dẫn giải bài tập môn Toán 5: Ôn tập tính chất cơ bản của phân số
2
658
289
Giải bài tập các môn
2
(New)
thông tin tài liệu
A. Tóm tắt kiến thức Tính chất hóa học của muối
I. Tính chất hóa học của muối
1. Tác dụng với kim loại
Dung dịch muối có thể tác dụng với kim loại tạo thành muối mới và kim loại mới.
Thí dụ: Fe + CuSO4 → FeSO4 + Cu↓
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag↓
2. Tác dụng với axit
Muối có thể tác dụng được với axit tạo thành muối mới và axit mới.
Thí dụ: BaCl2 + H2SO4 → 2HCl + BaSO4↓
CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O
3. Tác dụng với dung dịch muối
Hai dung dịch muối có thể tác dụng với nhau tạo thành hai muối mới.
Thí dụ: AgNO3 + NaCl → NaNO3 + AgCl↓
4. Tác dụng với dung dịch bazơ
Dung dịch bazơ có thể tác dụng với dung dịch bazơ tạo thành muối mới và bazơ mới.
Thí dụ: Na2CO3 + Ba(OH)2 → 2NaOH + BaCO3↓
5. Phản ứng phân hủy muối
Nhiều muối bị phân hủy ở nhiệt độ cao như: KClO3, KMnO4, CaCO3,…
Thí dụ: 2KClO3 → 2KCl + 3O2
CaCO3 → CaO + CO2
Mở rộng để xem thêm
tài liệu mới trong mục này
tài liệu hot trong mục này
tài liệu giúp tôi
Nếu bạn không tìm thấy tài liệu mình cần có thể gửi yêu cầu ở đây để chúng tôi tìm giúp bạn!
xem nhiều trong tuần
CHÍNH SÁCH PHÁT TRIỂN: Bài 3 - Lý thuyết phát triển
Tiếng Anh lớp 3 - Đề thi học kỳ 2 trường Tiểu Học Nguyễn Khuyến, Đắk Lắk
Hướng dẫn chuyển Bookmarks từ Firefox sang Chrome
Giải bài tập SBT Tiếng Anh lớp 9 mới Unit 7
Làm gì để tránh biến chứng bệnh tiểu đường
Hướng dẫn đặt mật khẩu Facebook 2 lớp bằng Code Generator
yêu cầu tài liệu
Giúp bạn tìm tài liệu chưa có
×



