
Home
Giáo dục đào tạo
Giải bài tập các môn
Hướng dẫn Giải bài tập SGK Hóa lớp 9: Tính chất hóa học của axit
Hướng dẫn Giải bài tập SGK Hóa lớp 9: Tính chất hóa học của axit
H ng d n Gi i bài t p SGK Hóa l p 9: Tính ch t hóa h c c a axitướ ẫ ả ậ ớ ấ ọ ủ
A. Tóm t t ki n th c Tính ch t hóa h c c a axitắ ế ứ ấ ọ ủ
I.Tính ch t hóa h c c a axitấ ọ ủ
1. Axit làm đ i màu ch t ch th : Dung d ch axit làm đ i màu quỳ tím thành đ .ổ ấ ỉ ị ị ổ ỏ
2. Axit tác d ng v i kim lo iụ ớ ạ
Dung d ch axit tác d ng đ c v i m t s kim lo i t o thành mu i và gi i phóng khíị ụ ượ ớ ộ ố ạ ạ ố ả
hiđro
Thí d :ụ
3H2SO4 (dd loãng) + 2Al → Al2(SO4)3 + 3H2
2HCl + Fe → FeCl2 + H2
Nh ng kim lo i không tác d ng v i HCl, Hữ ạ ụ ớ 2SO4 loãng nh Cu, Ag, Hg,…ư
Chú ý: Axit HNO3 và H2SO4 đ c tác d ng đ c v i nhi u kim lo i nh ng không gi iặ ụ ượ ớ ề ạ ư ả
phóng hiđro.
3. Axit tác d ng v i baz t o thành mu i và n cụ ớ ơ ạ ố ướ
Thí d : Hụ2SO4 + Cu(OH)2 → CuSO4 + 2H2O
4. Axit tác d ng v i oxit baz t o thành mu i và n c.ụ ớ ơ ạ ố ướ
Thí d : Feụ2O3 + 6HCl → FeCl3 + 3H2O
Ngoài ra, axit còn tác d ng v i mu i.ụ ớ ố
II. Axit m nh và axit y uạ ế
D a vào kh năng ph n ng, axit đ c chia làm 2 lo i:ự ả ả ứ ượ ạ
+ Axit m nh nh HCl, Hạ ư 2SO4, HNO3,…
+ Axit y u nh Hế ư 2S, H2CO3,…
B. Gi i bài t p sách giáo khoa trang 14 Hóa l p 9 t p 1ả ậ ớ ậ
Bài 1. (SGK hóa trang 14)
T Mg, MgO, Mg(OH)ừ2 và dung d ch axit sunfuric loãng, hãy vi t các ph ng trình hóaị ế ươ
h c c a ph n ng đi u ch magie sunfat.ọ ủ ả ứ ề ế
Đáp án và h ng d n gi i bài 1:ướ ẫ ả
Mg + H2SO4 → MgSO4 + H2
MgO + H2SO4 → MgSO4 + H2O
Mg(OH)2 + H2SO4 → MgSO4 + 2H2O
Bài 2. (SGK hóa trang 14)
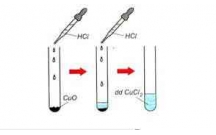
Có nh ng ch t sau: CuO, Mg, Alữ ấ 2O3, Fe(OH)3, Fe2O3. Hãy ch n m t trong nh ng ch tọ ộ ữ ấ
đã cho tác d ng v i dung d ch HCl sinh ra:ụ ớ ị
a) Khí nh h n không khí và cháy đ c trong không khí.ẹ ơ ượ
b) Dung d ch có màu xanh lamị
c) Dung d ch có màu vàng nâuị
d) Dung d ch không có màu.ị
Vi t các ph ng trình hóa h c.ế ươ ọ
Đáp án và h ng d n gi i bài 2:ướ ẫ ả
a) Khí nh h n không khí và cháy đ c trong không khí là khí Hẹ ơ ượ 2;
Mg + 2HCl → MgCl2 + H2
b) Dung d ch có màu xanh lam là dung d ch mu i đ ng (II).ị ị ố ồ
CuO + 2HCl → CuCl2 + H2O
c) Dung d ch có màu vàng nâu là dung d ch mu i s t (III)ị ị ố ắ
Fe(OH)3 + 3HCl → FeCl3 + 3H2O
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
d) Dung d ch không có màu là dung d ch mu i nhôm.ị ị ố
Al2O3 + 6HCl → 2AlCl3 + 3H2O.
Bài 3. (SGK hóa trang 14)
Hãy vi t các ph ng trình hóa h c c a ph n ng trong m i tr ng h p sau:ế ươ ọ ủ ả ứ ỗ ườ ợ
a) Magie oxit và axit nitric; d) S t và axit clohiđric;ắ
b) Đ ng (II) oxit và axit clohiđric; e) K m và axit sunfuric loãng.ồ ẽ
c) Nhôm oxit và axit sunfuric;
Đáp án và h ng d n gi i bài 3:ướ ẫ ả
a) MgO + 2HNO3 → Mg(NO3)2 + H2O
b) CuO + 2HCl → CuCl2 + H2O
c) Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
d) Fe + 2HCl → FeCl2 + H2
e) Zn + H2SO4 → ZnSO4 + H2
Bài 4. (SGK hóa trang 14)
Có 10 gam h n h p b t hai kim lo i đ ng và s t. Hãy gi i thi u ph ng pháp xác đ nhỗ ợ ộ ạ ồ ắ ớ ệ ươ ị
thành ph n ph n trăm (theo kh i l ng) c a m i kim lo i trong h n h p theo:ầ ầ ố ượ ủ ỗ ạ ỗ ợ
a) Ph ng pháp hóa h c. Vi t ph ng trình hóa h c.ươ ọ ế ươ ọ
b) Ph ng pháp v t lí.ươ ậ
(Bi t r ng đ ng không tác d ng v i axit HCl và axit Hế ằ ồ ụ ớ 2SO4 loãng)
Đáp án và h ng d n gi i bài 4:ướ ẫ ả
a) Ph ng pháp v t lí: Dùng thanh nam châm, sau khi đã b c đ u nam châm b ngươ ậ ọ ầ ằ
m nh nilon m ng và nh . Chà nhi u l n vào h n h p đ l y riêng Fe ra (Vì s t b namả ỏ ỏ ề ầ ỗ ợ ể ấ ắ ị
châm hút còn đ ng không b nam châm hút), r i đem cân. Gi s có m gam Fe. Thànhồ ị ồ ả ử
ph n ph n trăm theo kh i l ng c a s t là:ầ ầ ố ượ ủ ắ
%Fe = m/10 .100%
Suy ra: %Cu = 100% – %Fe
Ph ng trình hóa h c: Fe + 2 HCl → FeClươ ọ 2 + H2
Cu+HCl → Không x y ra ph ng trình ph n ng hóa h cả ươ ả ứ ọ
b) Ph ng pháp hóa h c: Ngâm h n h p b t Fe và Cu vào dung d ch axit HCl ho cươ ọ ỗ ợ ộ ị ặ
H2SO4 loãng, l y d cho đ n khi khí ng ng thoát ra (Fe đã ph n ng h t), l c l y ch tấ ư ế ừ ả ứ ế ọ ấ ấ
r n còn l i, r a nhi u l n trên gi y l c, làm khô và cân. Ch t r n đó là Cu. Gi s cóắ ạ ử ề ầ ấ ọ ấ ắ ả ử
m gam Cu. Thành ph n ph n trăm theo kh i l ng c a đ ng là:ầ ầ ố ượ ủ ồ
%Cu = m/10.100%
Suy ra: %Fe = 100% – %Cu
có thể bạn quan tâm

Hướng dẫn Giải bài tập bài tập Hóa lớp 9: Luyện tập tính chất hóa học...
3
819
365
Giải bài tập các môn
3
(New)

Hướng dẫn giải bài tập hóa học lớp 9 Thực hành: Tính chất hóa học của...
2
760
326
Giải bài tập các môn
2
(New)

Hướng dẫn Giải bài tập Hóa học lớp 11: Luyện tập tính chất của nitơ, p...
4
840
316
Giải bài tập các môn
4
(New)

Tóm tắt kiến thức cơ bản và giải bài tập Hóa học lớp 11: Sự điện li củ...
3
812
334
Giải bài tập các môn
3
(New)
Hướng dẫn Giải bài tập Hóa lớp 9: Tính chất hóa học của oxit
3
732
371
Giải bài tập các môn
3
(New)
Hướng dẫn Giải bài tập Hóa lớp 9: Tính chất hóa học của Bazơ
3
888
327
Giải bài tập các môn
3
(New)

Hướng dẫn Giải bài tập Hóa lớp 9: Tính chất hóa học của muối
5
802
415
Giải bài tập các môn
5
(New)

Hướng dẫn Giải bài tập Hóa lớp 9: Tính chất vật lý của kim loại
3
786
348
Giải bài tập các môn
3
(New)
thông tin tài liệu
A. Tóm tắt kiến thức Tính chất hóa học của axit
I.Tính chất hóa học của axit
1. Axit làm đổi màu chất chỉ thị: Dung dịch axit làm đổi màu quỳ tím thành đỏ.
2. Axit tác dụng với kim loại
Dung dịch axit tác dụng được với một số kim loại tạo thành muối và giải phóng khí hiđro
Thí dụ:
3H2SO4 (dd loãng) + 2Al → Al2(SO4)3 + 3H2
2HCl + Fe → FeCl2 + H2
Những kim loại không tác dụng với HCl, H2SO4 loãng như Cu, Ag, Hg,…
Chú ý: Axit HNO3 và H2SO4 đặc tác dụng được với nhiều kim loại nhưng không giải phóng hiđro.
3. Axit tác dụng với bazơ tạo thành muối và nước
Thí dụ: H2SO4 + Cu(OH)2 → CuSO4 + 2H2O
4. Axit tác dụng với oxit bazơ tạo thành muối và nước.
Thí dụ: Fe2O3 + 6HCl → FeCl3 + 3H2O
Ngoài ra, axit còn tác dụng với muối.
II. Axit mạnh và axit yếu
Dựa vào khả năng phản ứng, axit được chia làm 2 loại:
+ Axit mạnh như HCl, H2SO4, HNO3,…
+ Axit yếu như H2S, H2CO3,…
B. Giải bài tập sách giáo khoa trang 14 Hóa lớp 9 tập 1
Bài 1. (SGK hóa trang 14)
Từ Mg, MgO, Mg(OH)2 và dung dịch axit sunfuric loãng, hãy viết các phương trình hóa học của phản ứng điều chế magie sunfat.
Đáp án và hướng dẫn giải bài 1:
Mg + H2SO4 → MgSO4 + H2
Mở rộng để xem thêm
tài liệu mới trong mục này
tài liệu hot trong mục này
tài liệu giúp tôi
Nếu bạn không tìm thấy tài liệu mình cần có thể gửi yêu cầu ở đây để chúng tôi tìm giúp bạn!
xem nhiều trong tuần
CHÍNH SÁCH PHÁT TRIỂN: Bài 3 - Lý thuyết phát triển
Tiếng Anh lớp 3 - Đề thi học kỳ 2 trường Tiểu Học Nguyễn Khuyến, Đắk Lắk
Hướng dẫn chuyển Bookmarks từ Firefox sang Chrome
Giải bài tập SBT Tiếng Anh lớp 9 mới Unit 7
Làm gì để tránh biến chứng bệnh tiểu đường
Hướng dẫn đặt mật khẩu Facebook 2 lớp bằng Code Generator
yêu cầu tài liệu
Giúp bạn tìm tài liệu chưa có
×



