
Home
Giáo dục đào tạo
Giải bài tập các môn
Tóm tắt kiến thức cơ bản và Giải bài tập Hóa học lớp 11: Axit nitric và muối nitrat
Tóm tắt kiến thức cơ bản và Giải bài tập Hóa học lớp 11: Axit nitric và muối nitrat
Tóm t t ki n th c c b nắ ế ứ ơ ả và Gi i bài t p Hóa h c l p 11: ả ậ ọ ớ Axit nitric và mu iố
nitrat
I. Tóm t t ki n th c c b n: Axit nitric và mu i nitratắ ế ứ ơ ả ố
1. Trong h p ch t HNOợ ấ 3, nguyên t nit có s oxi hóa cao nh t là +5ố ơ ố ấ
2. Axit nitric tinh khi t là ch t l ng không màu, b c khói m nh trong không khí m.ế ấ ỏ ố ạ ẩ
Axit HNO3 tan trong n c theo b t kì t l nào.ướ ấ ỉ ệ
3. Axit HNO3 là m t trong các axit m nh: ộ ạ Làm quỳ tím hóa đ , tác d ng v i baz vàỏ ụ ớ ơ
oxit baz , tác d ng v i mu i c a axit y u.ơ ụ ớ ố ủ ế
- Axit HN3 là ch t oxi hóa m nh: ấ ạ Ph n ng v i h u h t các kim lo i tr Pt và Au, m tả ứ ớ ầ ế ạ ừ ộ
s phi kim, nhi u h p ch t vô c và h u c . S n ph m kh sinh ra tùy thu c n ng đố ề ợ ấ ơ ữ ơ ả ẩ ử ộ ồ ộ
axit, tính kh c a kim lo i và nhi t đ ph n ng.ử ủ ạ ệ ộ ả ứ
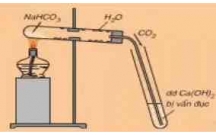
4. Trong phòng thí nghi m axit HNOệ3 đ c đi u ch b ng cách cho NaNOượ ề ế ằ 3 ho c KNOặ3
tác d ng v i axit Hụ ớ 2SO4 đăc, nóng:
2NaNO3(tt) + H2SO4(đ) →t0 Na2SO4 + 2HNO3
Trong công nghi p đ c s n xu t theo s đ sau:ệ ượ ả ấ ơ ồ
5. T t c các mu i nitrat đ u tan nhi u trong n c và là ch t đi n li m nh. Các mu iấ ả ố ề ề ướ ấ ệ ạ ố
nitrat kém b n v i nhi t, chúng b phân h y khi đun nóng: ề ớ ệ ị ủ Mu i nitrat c a các kim lo iố ủ ạ
ho t đ ng m nh (kali, natri,…) b phân h y thành mu i nitrit và oxi; mu i nitrat c aạ ộ ạ ị ủ ố ố ủ
magie, k m, s t, chì, đ ng,…b phân h y thành oxit kim lo i t ng ng, NOẽ ắ ồ ị ủ ạ ươ ứ 2 và O2;
mu i nitrat c a b c, vàng, th y ngân,… b phân h y thành kim lo i t ng ng, khíố ủ ạ ủ ị ủ ạ ươ ứ
NO2 và O2.
II. Gi i bài t p trang 45 SGK Hóa h c l p 11ả ậ ọ ớ
Bài 1. Vi t công th c electron, công th c c u t o c a axit nitric. Cho bi t nguyên tế ứ ứ ấ ạ ủ ế ố
nit có hóa tr và s oxi hóa bao nhiêu?ơ ị ố
Tr l i: ả ờ
Trong HNO3, nit có s oxi hóa +5 và hóa tr là 4ơ ố ị
Bài 2. L p các ph ng trình hóa h c:ậ ươ ọ
a) Ag + HNO3 (đ c)ặ → NO2 + ? + ?
b) Ag + HNO3 (loãng) → NO + ? + ?
c) Al + HNO3 → N2O + ? + ?
d) Zn + HNO3 → NH4NO3 + ? + ?
e) FeO + HNO3 → NO + Fe(NO3)3 + ?
g) Fe3O4 + HNO3 → NO + Fe(NO3)3 + ?
Tr l i: ả ờ Tr c h t, căn c vào tính ch t, đi n công th c các ch t còn thi u ch cóướ ế ứ ấ ề ứ ấ ế ở ỗ
d u (?). Sau đó, cân b ng pthh theo ph ng pháp thăng b ng electron, ta đ c k t quấ ằ ươ ằ ượ ế ả
sau:
a) Ag + 2HNO3 (đ c) → NOặ2 + AgNO3 + H2O
b) 3Ag + 4HNO3 (loãng) → NO + 3AgNO3 + 2H2O
c) 8Al + 30HNO3 → 3N2O + 8Al(NO3)3 + 15H2O
d) 4Zn + 10HNO3 → NH4NO3 + 4Zn(NO3)2 + 3H2O
e) 3FeO + 10HNO3 → NO + 3Fe(NO3)3 + 5H2O
g) 3Fe3O4 + 28HNO3 → NO + 9Fe(NO3)3 + 14H2O
Bài 3. Hãy ch ra nh ng tính ch t hóa h c chung và khác bi t gi a axit nitric và axitỉ ữ ấ ọ ệ ữ
sunfuric. Vi t các ph ng trình hóa h c đ minh h a.ế ươ ọ ể ọ
Tr l i: ả ờ Axit nitric và axit sunfuric đ c đ u có tính oxi hóa m nh.ặ ề ạ
Ví d : 3FeO +10HNOụ3 —> 3Fe(NO3)3 + NO ↓+ 5H2O
2FeO + 4H2SO4 —> Fe2(SO4)3 + SO2 + 4H2O
Tuy nhiên n u nh HNOế ư 3 loãng v n có tính oxi hóa thì Hẫ2SO4 loãng l i không có tínhạ
oxi hóa.
Ví dụ:
3Fe3O4 + 28HNO3 —> 9Fe(NO3)3 + NO↓ + 14H2O
Fe3O4 + 4H2SO4 —> FeSO4 + Fe2(SO4)3 + 4H2O
Bài 4.
a) Trong ph ng trình hóa h c c a ph n ng nhi t phân s t (III) nitrat, t ng các h sươ ọ ủ ả ứ ệ ắ ổ ệ ố
b ng bao nhiêu?ằ
A. 5 B. 7 C. 9 D. 21
b) Trong ph ng trình hóa h c c a ph n ng nhi t phân th y ngân (II) nitrat, t ng cácươ ọ ủ ả ứ ệ ủ ổ
h s b ng bao nhiêu?ệ ố ằ
A. 5 B. 7 C. 9 D. 21
Tr l iả ờ
a) Ch n D. 21ọ
4Fe(NO3)3 →t0 2Fe2O3 + 12NO2 + 3O2
b) Ch n A. 5ọ
Hg(NO3)3 →t0 Hg + 2NO2 + O2
Bài 5. Vi t ph ng trình hóa h c c a các ph n ng th c hi n dãy chuy n hóa sau đây:ế ươ ọ ủ ả ứ ự ệ ể
NO2 → (1)HNO3 → (2)Cu(NO3)2 → (3)Cu(OH)2 → (4)Cu(NO3)2 → (5)CuO → (6)Cu →
(7)CuCl2
Tr l i: ả ờ Ph ng trình hóa h cươ ọ
4NO2 + 2H2O -> 4HNO3
CuO + 2HNO2 -> Cu(NO3)2 + H2O
Cu(NO3)2 + 2NaOH -> Cu(OH)2↓ + 2NaNO3
Cu(OH)2 + 2HNO3 -> Cu(NO3)2 + 2H2O
Cu(NO3)2 ->t0 CuO + 2NO2↑ + ½ O2 ↑
CuO + H2 ->t0 Cu + H2O
Bài 6. Khi hòa tan 30,0 g h n h p đ ng và đ ng (II) oxit trong 1,50 lít dung d ch axitỗ ợ ồ ồ ị
nitric 1,00 M (loãng) th y thoát ra 6,72 lít nit monoaxit (đktc). Xác đ nh hàm l ngấ ơ ị ượ
ph n trăm c a đ ng (II) oxit trong h n h p, n ng đ mol c a đ ng (II) nitrat và axitầ ủ ồ ỗ ợ ồ ộ ủ ồ
nitric trong dung d ch sau ph n ng, bi t r ng th tích dung d ch không thay đ i.ị ả ứ ế ằ ể ị ổ
Tr l i: ả ờ
nNO = 6,72/22,4 = 0,300 (mol)
nHNO3 = 1,00 x 1,5 = 1,5 (mol)
pthh: 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O (1)
Theo (1) ta tính đ c nCuượ = 0,45 mol => mCu = 28,8 gam
nHNO3 = 1,2 mol
nCu(NO3)2 = 0,45 mol
mCuO = 30 gam – 28,8 gam = 1,2 gam => nCuO = 0,015 mol
CuO + 2HNO3 → Cu(NO3)2 + H2O (2)
Theo (2) ta tính đ cượ nHNO3 là 0,030 mol,
nCu(NO3)2 là 0,015 mol
Ph n trăm kh i l ng CuO: % mCuOầ ố ượ = 1,2/30 . 100% = 4,0 %
T (1) và (2) ta tính đ c s mol HNOừ ượ ố 3 d là 0,27 mol.ư
N ng đ mol HNOồ ộ 3 sau ph n ng: 0,18 Mả ứ
N ng đ mol c a Cu(NOồ ộ ủ 3)2: 0,31 M
Bài 7. Đ đi u ch 5,000 t n axit nitric n ng đ 60,0 % c n dùng bao nhiêu t nể ề ế ấ ồ ộ ầ ấ
amoniac? Bi t r ng s hao h t amoniac trong quá trình s n xu là 3,8 %.ế ằ ự ụ ả ẩ
Tr l iả ờ
Tính kh i l ng HNOố ượ 3 nguyên ch t: 3,00 t n.ấ ấ
Pthh: 4NH3 + 5O2 → (850 – 9000C)/Pt
4NO + 6H2O (1)
2NO + O2 → 2NO2 (2)
4NO2 + O2 + 2H2O → 4HNO3 (3)
T các ph ng trình trên ta có s đ h p th c: NHừ ươ ơ ồ ợ ứ 3 → HNO3 (4)
Theo (4), ta tính đ c kh i l ng NHượ ố ượ 3 (bao h t 3,8 %):ụ
(3,00.17,0)/63,0 x (100/96,2) = 0,841 (t n)ấ
có thể bạn quan tâm

Tóm tắt kiến thức cơ bản và giải bài tập Hóa học lớp 11: Axit, bazơ và...
3
1.321
408
Giải bài tập các môn
3
(New)

Tóm tắt kiến thức cơ bản và Giải bài tập Hóa học lớp 11: Axit photphor...
3
848
375
Giải bài tập các môn
3
(New)

Tóm tắt kiến thức cơ bản và giải bài tập Hóa học lớp 11: Amoniac và mu...
4
920
392
Giải bài tập các môn
4
(New)
Giải bài tập Hóa Học 9: Axit cacbonic và muối cacbonat
2
1.173
508
Giải bài tập các môn
2
(New)
Tóm tắt kiến thức và Giải bài tập Sinh học lớp 11: Sự hấp thụ nước và...
3
704
345
Giải bài tập các môn
3
(New)

Tóm tắt kiến thức cơ bản và giải bài tập Hóa học lớp 11: Sự điện li củ...
3
1.019
395
Giải bài tập các môn
3
(New)

HÓA HỌC 8 LÝ THUYẾT VÀ BÀI TẬP AXIT – BAZƠ - MUỐI
11
1.742
422
Giáo án, bài giảng lớp 8
11
(New)

HÓA HỌC TÌM HIỂU VỀ AXIT SUNFURIC, MUỐI SUNFAT (T2)
2
1.373
460
Giáo án, bài giảng lớp 10
2
(New)
thông tin tài liệu
I. Tóm tắt kiến thức cơ bản: Axit nitric và muối nitrat
1. Trong hợp chất HNO3, nguyên tố nitơ có số oxi hóa cao nhất là +5
2. Axit nitric tinh khiết là chất lỏng không màu, bốc khói mạnh trong không khí ẩm. Axit HNO3 tan trong nước theo bất kì tỉ lệ nào.
3. Axit HNO3 là một trong các axit mạnh: Làm quỳ tím hóa đỏ, tác dụng với bazơ và oxit bazơ, tác dụng với muối của axit yếu.
- Axit HN3 là chất oxi hóa mạnh: Phản ứng với hầu hết các kim loại trừ Pt và Au, một số phi kim, nhiều hợp chất vô cơ và hữu cơ. Sản phẩm khử sinh ra tùy thuộc nồng độ axit, tính khử của kim loại và nhiệt độ phản ứng.
4. Trong phòng thí nghiệm axit HNO3 được điều chế bằng cách cho NaNO3 hoặc KNO3 tác dụng với axit H2SO4 đăc, nóng:
2NaNO3(tt) + H2SO4(đ) →t0 Na2SO4 + 2HNO3
.....
Mở rộng để xem thêm
tài liệu mới trong mục này
tài liệu hot trong mục này
tài liệu giúp tôi
Nếu bạn không tìm thấy tài liệu mình cần có thể gửi yêu cầu ở đây để chúng tôi tìm giúp bạn!
×



