
Home
Giáo dục đào tạo
Giải bài tập các môn
Tóm tắt kiến thức cơ bản và giải bài tập Hóa học lớp 11: Luyện tập chương 1
Tóm tắt kiến thức cơ bản và giải bài tập Hóa học lớp 11: Luyện tập chương 1
Tóm t t ki n th c c b n và gi i bài t p Hóa h c l p 11: Luy n t p ch ng 1ắ ế ứ ơ ả ả ậ ọ ớ ệ ậ ươ
I. Tóm t t ki n th c: Luy n t p ch ng 1ắ ế ứ ệ ậ ươ
1. Thuy t axit ế- baz c a A-rê-ni-út.ơ ủ
- Axit là ch t khi tan trong n c phân li ra ion Hấ ướ +
- Baz là nh ng ch t khi tan trong n c phân li ra ion OHơ ữ ấ ướ -
- Hiđroxit l ng tính khi tan trong n c v a có th phân li nh axit v a phân li nhưỡ ướ ừ ể ư ừ ư
baz .ơ
- H u h t các mu i khi tan trong n c, đi n li hoàn toàn ra cationầ ế ố ướ ệ kim lo i (ho c cationạ ặ
NH4+) và anion g c axit.ố
- N u g c axit còn ch a hiđro có tính axit, thì g c đó đi n li y u ra cation Hế ố ứ ố ệ ế + và anion
g c axit.ố
2. Tích s ion c a n c làố ủ ướ
H2O = [H+].[OH-] = l,0.10-14 ( 25°C). Nó là h ng s trong n c cũng nh trong dungở ằ ố ướ ư
d ch loãng c a các ch t khác nhau.ị ủ ấ
3. Giá tr [Hị+] và pH đ c tr ng cho các môi tr ng:ặ ư ườ
Môi tr ng trung tính: [Hườ +] = 10-7M hay pH = 7,0
Môi tr ng axit: [Hườ +] > 10-7M hay pH < 7,0
Môi tr ng ki m: [Hườ ề +] < 10-7M hay pH > 7,0
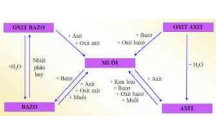
4. Ph nả ng trao đ i ion trong dung d ch các ch t đi n li ch x y ra khi có ít nh t m tứ ổ ị ấ ệ ỉ ả ấ ộ
trong các đi u ki n sau:ề ệ
a) T o thành ch tạ ấ k t t a.ế ủ
b) T o thành ch tạ ấ đi n li y u.ệ ế
c) T o thành ch tạ ấ khí.
5. Ph ng trình ion rút g n cho bi t b n ch t c a ph n ng trong dung d ch các ch tươ ọ ế ả ấ ủ ả ứ ị ấ
đi n li. Trong ph ng trình ion rút g n c a ph n ng, ng i ta l c b nh ng ionệ ươ ọ ủ ả ứ ườ ượ ỏ ữ
không tham gia ph n ng. Còn nh ng ch t k t t a, đi n li y u, ch t khí đ c giả ứ ữ ấ ế ủ ệ ế ấ ượ ữ
nguyên d i d ng phân t .ướ ạ ử
II. Gi i bài t p trang 22, 23 SGK Hóa h c l p 11ả ậ ọ ớ
Bài 1. Vi t ph ng trình đi n li c a các ch t sau: Kế ươ ệ ủ ấ 2S, Na2HPO4, NaH2PO4, Pb(OH)2,
HBrO, HF, HClO4..
Tr l i:ả ờ Ph ng trình đi n liươ ệ
a) K2S → 2K+ + S2-
b) Na2HPO4 → 2Na+ + HPO42-
HPO42- ⇔ H+ + PO43-
c) NaH2PO4 → Na+ + H2PO4-
H2PO4- H⇔+ + HPO42-
HPO42- H⇔+ + PO43-
d) Pb(OH)2 Pb⇔2+ + 2OH-. Phân li ki u bazể ơ
H2PbO2 ⇔ 2H+ + PbO22-. Phân li ki u axitể
e) HBrO H⇔+ + BrO-
g) HF H⇔+ + F-
h) HClO4 → H+ + ClO4-
Bài 2. M t dung d ch có [Hộ ị +] = 0,01 OM. Tính [OH-] và pH c a dung d ch. Môi tr ngủ ị ườ
c a dung d ch này là axit, trung tính hay ki m? Hãy cho bi t màu c a quỳ tím trongủ ị ề ế ủ
dung d ch này.ị
Tr l i:ả ờ [H+] = 1,0.10-2M thì pH = 2 và [OH-] = 1,0 . 10-12M.
Môi tr ng axit. Quỳ có màu đ .ườ ỏ
Bài 3. M t dung d ch có pH = 9,0. Tính n ng đ mol c a các ion Hộ ị ồ ộ ủ + và OH- trong dung
d ch. Hãy cho bi t màu c a phenolphtalein trong dung d ch này.ị ế ủ ị
Tr l i: ả ờ pH = 9,0 thì [H+] = 1,0. 10-9M và [OH-] = 1,0.10-5M.
Môi tr ng ki m. Trong dung d ch ki m thì phenolphtalein có màu h ng.ườ ể ị ề ồ
Bài 4. Vi t các ph ng trình phân t và ion rút g n c a các ph n ng (n u có) x y raế ươ ử ọ ủ ả ứ ế ả
trong dung d ch gi a các c p ch t sau:ị ữ ặ ấ
a) Na2CO3 + Ca(NO3)2
b) FeSO4 + NaOH (loãng)
c) NaHCO3 + HCI
d) NaHCO3 + NaOH
e) K2CO3 + NaCI
g) Pb(OH)2 (r) + HNO3
h) Pb(OH)2 (r) + NaOH
i) CuSO4 + Na2S
Tr l i: ả ờ Ph ng trình ion rút g n:ươ ọ
a) Ca2+ + CO32- → CaCO3 ↓
b) Fe2+ + 2OH- → Fe(OH)2↓
c) HCO3- + H+ → CO2 ↑ + H2O
d) HCO3- + OH- → H2O + CO32-
e) Không có ph ng trình ion rút g n.ươ ọ
g) Pb(OH)2 (r) + 2H+ → Pb2+ + 2H2O
h) H2PbO2 (r) + 2OH- → PbO22- + 2H2O
i) Cu2+ + S2- → CuS↓.
Bài 5. Ph n ng trao đ i ion trong dung d ch các ch t đi n li ch x y ra khiả ứ ổ ị ấ ệ ỉ ả
A. Các ch t ph n ng ph i là nh ng ch t d tan.ấ ả ứ ả ữ ấ ễ
B. Các ch t ph n ng ph i là nh ng ch t đi n li m nh.ấ ả ứ ả ữ ấ ệ ạ
C. M t s ion trong dung d ch k t h p đ c v i nhau làm gi m n ng đ ion c aộ ố ị ế ợ ượ ớ ả ồ ộ ủ
chúng
D. Ph n ng không ph i là thu n ngh ch.ả ứ ả ậ ị
Tr l i:ả ờ Ch n C. M t s ion trong dung d ch k t h p đ c v i nhau làm gi m n ng đọ ộ ố ị ế ợ ượ ớ ả ồ ộ
ion c a chúng.ủ
Bài 6. K t t a (hìnhế ủ 7a) đ c t o thành trong dung d ch b ng các c p ch t nào d iượ ạ ị ằ ặ ấ ướ
đây?
A. CdCl2 + NaOH B. Cd(NO3)2 + H2S
C. Cd(NO3)2 + HCl D. CdCl2 + Na2SO4
Tr l i: ả ờ Ch n B. Cd(NOọ3)2 + H2S → CdS↓ + 2HNO3
Bài 7. Vi t ph ng trình hoá h c (d i d ng phân t và ion rút g n) c a ph n ngế ươ ọ ướ ạ ử ọ ủ ả ứ
trao đ i ion trong dung d ch t o thành t ng k t t a sau: Cr(OH)ổ ị ạ ừ ế ủ 3; Al(OH)3;
Ni(OH)2 (hình 1.7 b, c, d)
có thể bạn quan tâm

Tóm tắt kiến thức cơ bản và Giải bài tập Hóa học lớp 11: Luyện tập tín...
2
742
335
Giải bài tập các môn
2
(New)
Hướng dẫn Giải bài tập Hóa lớp 9: Luyện tập chương 1 - Các hợp chất vô...
3
715
314
Giải bài tập các môn
3
(New)

Hướng dẫn giải bài tập Sách giáo khoa Toán lớp 4: Luyện tập chung chươ...
6
793
303
Giải bài tập các môn
6
(New)

GIẢI BÀI TẬP VỞ BÀI TẬP TIẾNG VIỆT LỚP 4:TẬP LÀM VĂN - LUYỆN TẬP TRAO...
2
615
291
Giải bài tập các môn
2
(New)

Hệ thống kiến thức cơ bản và giải bài tập Toán lớp 8: Chia đa thức cho...
2
874
432
Tài liệu, đề thi môn Toán
2
(New)

Hệ thống kiến thức cơ bản và giải bài tập: Chia đơn thức cho đơn thức
2
923
367
Tài liệu, đề thi môn Toán
2
(New)

Tóm tắt kiến thức và Giải bài tập Toán lớp 6: Thứ tự thực hiện các phé...
5
945
356
Giải bài tập các môn
5
(New)

Tóm tắt kiến thức và giải bài tập Toán lớp 8: Chia đa thức một biến đã...
5
863
833
Tài liệu, đề thi môn Toán
5
(New)
thông tin tài liệu
I. Tóm tắt kiến thức: Luyện tập chương 1
1. Thuyết axit - bazơ của A-rê-ni-út.
- Axit là chất khi tan trong nước phân li ra ion H+
- Bazơ là những chất khi tan trong nước phân li ra ion OH-
- Hiđroxit lưỡng tính khi tan trong nước vừa có thể phân li như axit vừa phân li như bazơ.
- Hầu hết các muối khi tan trong nước, điện li hoàn toàn ra cation kim loại (hoặc cation NH4+) và anion gốc axit.
- Nếu gốc axit còn chứa hiđro có tính axit, thì gốc đó điện li yếu ra cation H+ và anion gốc axit.
2. Tích số ion của nước là
H2O = [H+].[OH-] = l,0.10-14 (ở 25°C). Nó là hằng số trong nước cũng như trong dung dịch loãng của các chất khác nhau.
3. Giá trị [H+] và pH đặc trưng cho các môi trường:
Môi trường trung tính: [H+] = 10-7M hay pH = 7,0
Môi trường axit: [H+] > 10-7M hay pH < 7,0
Môi trường kiềm: [H+] < 10-7M hay pH > 7,0
4. Phản ứng trao đổi ion trong dung dịch các chất điện li chỉ xảy ra khi có ít nhất một trong các điều kiện sau:
a) Tạo thành chất kết tủa.
b) Tạo thành chất điện li yếu.
c) Tạo thành chất khí.
5. Phương trình ion rút gọn cho biết bản chất của phản ứng trong dung dịch các chất điện li. Trong phương trình ion rút gọn của phản ứng, người ta lược bỏ những ion không tham gia phản ứng. Còn những chất kết tủa, điện li yếu, chất khí được giữ nguyên dưới dạng phân tử.
....
Mở rộng để xem thêm
tài liệu mới trong mục này
tài liệu hot trong mục này
tài liệu giúp tôi
Nếu bạn không tìm thấy tài liệu mình cần có thể gửi yêu cầu ở đây để chúng tôi tìm giúp bạn!
xem nhiều trong tuần
70 câu hỏi trắc nghiệm luyện thi chứng chỉ tin A
Đề thi và lời giải môn xác suất thống kê của trường Học viện ngân hàng
Địa lý 12 Phát triển cây công nghiệp lâu năm Tây Nguyên
Giáo trình Quản trị học của Đại học kinh tế quốc dân
Tiểu luận: Vị trí, vai trò, nhiệm vụ của người Đảng viên với ĐCSVN- Phấn đấu, rèn luyện và tuyên truyền nhân dân của người Đảng viên
Bài tập nâng cao Tiếng Việt lớp 2: Chính tả
yêu cầu tài liệu
Giúp bạn tìm tài liệu chưa có
×



