
Home
Giáo dục đào tạo
Giải bài tập các môn
Tóm tắt lý thuyết cơ bản và giải bài tập Hóa học lớp 11: Sự điện li
Tóm tắt lý thuyết cơ bản và giải bài tập Hóa học lớp 11: Sự điện li
Tóm t t lý thuy t c b n và gi i bài t p Hóa h c l p 11: S đi n liắ ế ơ ả ả ậ ọ ớ ự ệ
I. Tóm t t ki n th c c b n: S đi n liắ ế ứ ơ ả ự ệ
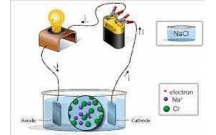
1. S đi n li là quá trình phân li các ch t trong n c ho c khi nóng ch y thành ion.ự ệ ấ ướ ặ ả
2. Dung d ch d n đi n đ c là do trong dung d ch c a chúng có các h t mang đi n tíchị ẫ ệ ượ ị ủ ạ ệ
chuy n đ ng t do đ c g i là các ion.ể ộ ự ượ ọ
3. Ch t đi n li là nh ng ch t khi tan trong n c phân li ra ion.ấ ệ ữ ấ ướ
- Axit, baz , mu i đ u là nh ng ch t đi n li.ơ ố ề ữ ấ ệ
- Ch t đi n li m nh là ch t khi tan trong n c, các phân t hòa tan phân li hoàn toàn.ấ ệ ạ ấ ướ ử
- Các axit m nh, baz m nh và h u h t các mu i làạ ơ ạ ầ ế ố ch t đi n li m nh.ấ ệ ạ
- Ch t đi n li y u là ch t khi tan trong n c, s phân t hòa tan phân li m t ph n,ấ ệ ế ấ ướ ố ử ộ ầ
ph n còn l i v n t n t i d i d ng phân t trong dung d ch. Các axit y u, baz y u vàầ ạ ẫ ồ ạ ướ ạ ử ị ế ơ ế
m t s mu i là ch t đi n li y u.ộ ố ố ấ ệ ế
- Ch t không đi n li là nh ng ch t khi tan trong n c không phân li ra ion.ấ ệ ữ ấ ướ
Ví d : Dung d ch đ ng, dung d ch r u, …ụ ị ườ ị ượ
4. Cân b ng đi n li: S phân li c a các ch t đi n li y u là quá trình thu n ngh ch. Khiằ ệ ự ủ ấ ệ ế ậ ị
t c đ phân li c a phân t ch t đi n li (ph n ng thu n) b ng t c đ k t h p gi a cácố ộ ủ ử ấ ệ ả ứ ậ ằ ố ộ ế ợ ữ
ion thành phân t ch t đi n li (ph n ng ngh ch) thì cân b ng c a quá trình đi n liử ấ ệ ả ứ ị ằ ủ ệ
đ c thi t l p.ượ ế ậ
II. Gi i bài t p ả ậ trang 7 SGK Hóa h c l p 11ọ ớ
Bài 1. Các dung d ch axitị nh HCl, baz nh NaOH và mu i nh NaCl d n đi nư ơ ư ố ư ẫ ệ
đ c, còn các dung d ch nh ancol etylic, saccaroz , glixerol không d n đi n là doượ ị ư ơ ẫ ệ
nguyên nhân gì?
Tr l i:ả ờ Các dung d ch HCl, NaOH, NaCl d n đi n đ c vì trong dung d ch có s hi nị ẫ ệ ượ ị ự ệ
di n c a các ion. Các dung d ch ancol etylic, saccaroz , glixerol không d n đi n đ cệ ủ ị ơ ẫ ệ ượ
vì trong dung d ch không có s hi n di n c a các ion.ị ự ệ ệ ủ
Bài 2. S đi n li, ch t đi n li là gì?ự ệ ấ ệ
Nh ng lo i ch t nào là ch t đi n li?ữ ạ ấ ấ ệ Th nào là ch t đi n li m nh, ch t đi n li y u?ế ấ ệ ạ ấ ệ ế
L y thí d và vi t ph ng trình đi n li c a chúng.ấ ụ ế ươ ệ ủ
Tr l i:ả ờ
- Quá trình phân li các ch t trong n c ra ion g i là s đi n li.ấ ướ ọ ự ệ
- Nh ng ch t tan trong n c phân li ra ion g i là nh ng ch t đi n liữ ấ ướ ọ ữ ấ ệ
- Axit, baz , mu i là nh ng ch t đi n li.ơ ố ữ ấ ệ
- Ch t đi n li m nh là các ch t khi tan trong n c, các phân t hòa tan đ u phân li raấ ệ ạ ấ ướ ử ề
ion. Ví d : NHụ4Cl --> NH4+ + Cl-
- Ch t đi n li y u là ch t khi tan trong n c, các phân t hòa tan ch phân li m t ph nấ ệ ế ấ ướ ử ỉ ộ ầ
ra ion, ph n còn l i v n t n t i d i d ng phân t trong dung d ch. ầ ạ ẫ ồ ạ ướ ạ ử ị
Ví d CHụ3COOH CH⇔3COO- + H+
Bài 3. Vi t ph ng trình đi n li c a nh ng ch t sau:ế ươ ệ ủ ữ ấ
a) Các ch t đi n li m nh:ấ ệ ạ Ba(NO3)2 0,10M; HNO3 0,020M; KOH 0,010M.
Tính n ng đ mol c a t ng ion trong các dung d ch trên.ồ ộ ủ ừ ị
b) Các ch t đi n li y u: HClO,ấ ệ ế HNO2.
Tr l iả ờ
a) Các ch t đi n li m nh phân li hoàn toàn nên ph ng trình đi n li vàấ ệ ạ ươ ệ n ng đ các ionồ ộ
trong dung d ch nh sau:ị ư
Ba(NO3)2 → Ba2+ + 2NO-3
0,01M 0,10M 0,20M
HNO3 → H+ + NO-3
0,020M 0,020M 0,020M
KOH → K+ + OH-
0,010M 0,010M 0,010M
b) Các ch t đi n li y u phân li không hoàn toàn nên ph ng trình đi n li nh sau:ấ ệ ế ươ ệ ư
HClO ⇔ H+ + ClO-
HNO2 ⇔ H+ + NO-2
Bài 4. Ch n câu tr l i đúng trong các câu sau đây:ọ ả ờ
Dung d ch ch t đi n li d n đi n đ c là doị ấ ệ ẫ ệ ượ :
A. S chuy n d ch c a các electron.ự ể ị ủ
B. S chuy n d ch c a các cation.ự ể ị ủ
C. S chuy n d ch c a các phân t hòa tan.ự ể ị ủ ử
D. S chuy n d ch c a c cation và anion.ự ể ị ủ ả
Tr l i:ả ờ Ch n D.ọ
Dung d ch ch t đi n li d n đi n đ c do s chuy n d ch c a c cation và anion.ị ấ ệ ẫ ệ ượ ự ể ị ủ ả
Bài 5. Ch t nào sau đây không d n đi n đ cấ ẫ ệ ượ ?
A. KCl r n, khan.ắ
B. CaCl2 nóng ch y.ả
C. NaOH nóng ch y.ả
D. HBr hòa tan trong n c.ướ
Tr l i: ả ờ Ch n A.ọ
KCl r n t n t i d i d ng tinh th ion. M ng tinh th KCl t ng t u m ng tinh thắ ồ ạ ướ ạ ể ạ ể ươ ự ạ ể
NaCl (hình 3.1 SGK l p 10). Tinh th ion r t b n v ng vì l c hút tĩnh đi n gi a các ionớ ể ấ ề ữ ự ệ ữ
ng c d u trong tinh th ion r t l n. Các ionượ ấ ể ấ ớ K+ và Cl- ch dao đ ng t i các đ u nút c aỉ ộ ạ ầ ủ
m ng tinh th (không chuy n d ch t do) vì v y, KCl r n, khan không d n đi n.ạ ể ể ị ự ậ ắ ẫ ệ
có thể bạn quan tâm
Tóm tắt lý thuyết và hướng dẫn giải bài tập Vật lý lớp 11 bài 2: Thuyế...
4
737
357
Giải bài tập các môn
4
(New)

Tóm tắt lý thuyết và giải bài tập Vật lý lớp 11 bài 3: Điện trường và...
8
826
359
Giải bài tập các môn
8
(New)

Tóm tắt lý thuyết và hướng dẫn giải bài tập Vật lý lớp 11 bài 1: Điện...
3
682
318
Giải bài tập các môn
3
(New)
Hướng dẫn Giải bài tập Sách bài tập Vật lý 11 bài 2: Thuyết electron –...
4
966
599
Giải bài tập các môn
4
(New)

Hướng dẫn Giải bài tập Sách bài tập Vật lý 12: Hiện tượng quang điện....
8
771
350
Giải bài tập các môn
8
(New)
Hướng dẫn Giải bài tập Sách bài tập Vật lý 11: Điện trường và cường độ...
5
862
460
Giải bài tập các môn
5
(New)
Hướng dẫn giải bài tập Vật lý lớp 9: Sự phụ thuộc của cường độ dòng đi...
2
758
356
Giải bài tập các môn
2
(New)
Tóm tắt kiến thức và giải bài tập Vật lý lớp 11: Dòng điện trong chất...
5
823
341
Tài liệu, đề thi môn Toán
5
(New)
thông tin tài liệu
I. Tóm tắt kiến thức cơ bản: Sự điện li
1. Sự điện li là quá trình phân li các chất trong nước hoặc khi nóng chảy thành ion.
2. Dung dịch dẫn điện được là do trong dung dịch của chúng có các hạt mang điện tích chuyển động tự do được gọi là các ion.
3. Chất điện li là những chất khi tan trong nước phân li ra ion.
- Axit, bazơ, muối đều là những chất điện li.
- Chất điện li mạnh là chất khi tan trong nước, các phân tử hòa tan phân li hoàn toàn.
- Các axit mạnh, bazơ mạnh và hầu hết các muối là chất điện li mạnh.
- Chất điện li yếu là chất khi tan trong nước, số phân tử hòa tan phân li một phần, phần còn lại vẫn tồn tại dưới dạng phân tử trong dung dịch. Các axit yếu, bazơ yếu và một số muối là chất điện li yếu.
- Chất không điện li là những chất khi tan trong nước không phân li ra ion.
Ví dụ: Dung dịch đường, dung dịch rượu, …
4. Cân bằng điện li: Sự phân li của các chất điện li yếu là quá trình thuận nghịch. Khi tốc độ phân li của phân tử chất điện li (phản ứng thuận) bằng tốc độ kết hợp giữa các ion thành phân tử chất điện li (phản ứng nghịch) thì cân bằng của quá trình điện li được thiết lập.
....
Mở rộng để xem thêm
tài liệu mới trong mục này
tài liệu hot trong mục này
tài liệu giúp tôi
Nếu bạn không tìm thấy tài liệu mình cần có thể gửi yêu cầu ở đây để chúng tôi tìm giúp bạn!
xem nhiều trong tuần
70 câu hỏi trắc nghiệm luyện thi chứng chỉ tin A
Đề thi và lời giải môn xác suất thống kê của trường Học viện ngân hàng
Địa lý 12 Phát triển cây công nghiệp lâu năm Tây Nguyên
Giáo trình Quản trị học của Đại học kinh tế quốc dân
Tiểu luận: Vị trí, vai trò, nhiệm vụ của người Đảng viên với ĐCSVN- Phấn đấu, rèn luyện và tuyên truyền nhân dân của người Đảng viên
Bài tập nâng cao Tiếng Việt lớp 2: Chính tả
yêu cầu tài liệu
Giúp bạn tìm tài liệu chưa có
×



